微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 可逆反应2A(g)+3B(g)?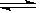 ?2c(g)+D(g)在四种不同条件下的反应速率分别为
?2c(g)+D(g)在四种不同条件下的反应速率分别为
①v(A)="0.5" mol/(L·min)??????????②v(B)="0.6" mol/(L·min)
③v(C)="0.35" mol/(L·min)?????????④v(D)="0.4" mol/(L·min)
则该反应在不同条件下反应速率最快的是(???)
A.①??????????B.②????????? C.③?????????D.④
参考答案:D
本题解析:同一个化学反应用不同的物质表示其反应速率时,数值可能是不同的,但表示的意义是相同放热。因此比较反应速率快慢时不能直接比较速率数值大小,而是要首先换算成用同一种物质表示,然后才能直接比较速率数值大小。根据速率之比是相应的化学计量数之比可知,如果都用A物质表示,则分别为0.5 mol/(L·min)、0.4 mol/(L·min)、0.35 mol/(L·min)、0.8 mol/(L·min),所以答案是D。
本题难度:一般
2、填空题 已知草酸(H2C2O4)是一种二元弱酸,主要用作还原剂和漂白剂。
(1)草酸的电离方程式为 ; 。
(2)将草酸溶液与酸性高锰酸钾溶液混合发生的反应为:
MnO4-+ H2C2O4+ → Mn2+ + CO2↑+ H2O
某合作小组同学在烧杯中进行上述反应时,发现刚开始一段时间,反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快。
①配平上述离子方程式
②该实验不久后溶液突然褪色的原因最有可能是 。
A.体系压强增大 B.反应物接触面积增大
C.生成物对反应有催化作用 D.反应物浓度增大
(3)为研究该化学反应速率的影响因素,某同学进行了以下实验:
组别
| 温度/℃
| V(H2C2O4)
/mL
| V(KMnO4)
/mL
| V(H2O)
/mL
| KMnO4溶液
褪色时间/s
|
1
| 30
| 10
| 10
| 20
| 40
|
2
| 30
| 20
| 20
| 0
| t
|
3
| 30
|
|
| 15
|
①对比实验1和3要研究改变反应物浓度对化学反应速率的影响,请完成表格中横线。
②实验2中溶液褪色时间t 为
A.>40 B.=40 C.<40 D.无法判断
参考答案:(10分)(1)H2C2O4 本题解析: 本题解析:
试题分析:(1)草酸(H2C2O4)是一种二元弱酸,电离方程式为H2C2O4 H++ HC2O4—;(2)①根据化合价升降法及元素守恒配平离子方程式为2MnO4-+5H2C2O4+6H+ ==2Mn2++10CO2↑+8H2O ;②溶液突然褪色,说明反应速率突然增大,原因最有可能是催化剂,答案选C;(3)①变量控制,总体积为40ml,加水15ml,与实验1比较,可得答案;②反应不是均速进行,由于生成物有催化作用,无法确定褪色时间,答案选D。 H++ HC2O4—;(2)①根据化合价升降法及元素守恒配平离子方程式为2MnO4-+5H2C2O4+6H+ ==2Mn2++10CO2↑+8H2O ;②溶液突然褪色,说明反应速率突然增大,原因最有可能是催化剂,答案选C;(3)①变量控制,总体积为40ml,加水15ml,与实验1比较,可得答案;②反应不是均速进行,由于生成物有催化作用,无法确定褪色时间,答案选D。
考点:草酸的性质、电离、氧化还原反应、化学反应速率
本题难度:困难
3、选择题 反应A(g)+3B(g)=2C(g)+2D(g)在四种不同情况下的反应速率分别为
①v(A)=0.45 mol·L-1·min-1 ②v(B)=0.6 mol·L-1·s-1
③v(C)=0.4 mol·L-1·s-1 ④v(D)=0.45 mol·L-1·s-1
下列有关反应速率的比较中正确的是
A.④>③=②>① B.④<③=②<① C.①>②>③>④ D.④>③>②>①
参考答案:A
本题解析:
试题分析:都用同种物质速率来表示,然后再比较其大小。不妨用A的速率来表示。②v(A)="1
本题难度:一般
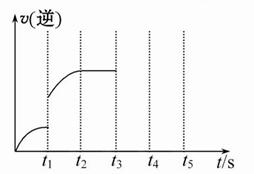
4、填空题 在5 L密闭容器中加入2 mol Fe(s)与1 mol H2O(g),t1秒时,H2的物质的量为0.20 mol,到第t2秒时恰好达到平衡,此时H2的物质的量为0.35 mol。
(1)t1~t2这段时间内的化学反应速率v(H2)=????????????。
(2)若继续加入2 mol Fe(s),则平衡移动??????(填“向正反应方向”、“向逆反应方向”或“不”),继续通入1 mol H2O(g)再次达到平衡后,H2物质的量为??????? __________mol。
(3)该反应的逆反应速率随时间变化的关系如图。t1时改变了某种条件,改变的条件是? _________。
参考答案:(1)0.03/(t2-t1)? mol·L-1·s-1
本题解析:(1)t1~t2时间段内H2物质的量的变化为0.35 mol-0.20 mol="0.15" mol,v(H2)="0.15" mol/[5 L×(t2-t1)s]=0.03/(t2-t1) mol·L-1·s-1。
(2)Fe为固体,加入Fe对平衡无影响,平衡不移动。根据反应3Fe(s)+4H2O(g) 
本题难度:一般
5、选择题 已知下列各组反应的反应物及温度,则反应开始时,放出H2的速率最快的是(表中的物质均为反应物)
编号
| 金属(大小、形状相同的粉末)物质的量
| 酸的浓度及体积
| 反应温度/℃
| A
| Mg 0.1 mol
| 3 mol/L的硝酸10 mL
| 60
| B
| Mg 0.1 mol
| 3 mol/L的盐酸10 mL
| 30
| C
| Fe 0.1 mol
| 3 mol/L的盐酸10 mL
| 60
| D
| Mg 0.1 mol
| 3 mol/L的盐酸10 mL
| 60
参考答案:D
本题解析:
试题分析:A、Mg与硝酸反应不会产生氢气,错误;B、C、D的反应中Mg比Fe活泼,反应速率快,B、D反应条件中, D的温度高于B,反应速率快,所以放出氢气最快的是D,答案选D。
考点:考查反应速率的判断
本题难度:一般
|
|