微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 硫--碘循环分解水制氢主要涉及下列反应:
Ⅰ.SO2 +2H2O +I2 =H2SO4 +2HI
Ⅱ.2HI H2 +I2
H2 +I2
Ⅲ.2H2SO4 =2SO2 +O2 +2H2O
(1)分析上述反应,下列判断正确的是_______
a.反应Ⅲ易在常温下进行
b.反应I中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。

0~2 min内的平均反应速率v(HI)=____。该温度下,H2(g)+I2(g)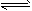 2HI(g)的平衡常数K=____ 相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则____是原来的2倍。
2HI(g)的平衡常数K=____ 相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则____是原来的2倍。
a.平衡常数 b.HI的平衡浓度 c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡____移动(填“向左”、“向右”或“不”); 若加入少量下列试剂中的____,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
参考答案:(1)c
(2)0.1 mol·L-1·min-1;
本题解析:
本题难度:一般
2、填空题 10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度(℃)
| 10
| 20
| 30
| 加热煮沸后冷却到50℃
|
pH
| 8.3
| 8.4
| 8.5
| 8.8
甲同学认为,该溶液的pH值升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为 。
乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度 (填“大于”或“小于”)NaHCO3。
丙同学认为甲、乙的判断都不充分。丙认为:___________________________
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则 (填“甲”或“乙”)判断正确。试剂X是 。
A、Ba(OH)2溶液 B、BaCl2溶液 C、NaOH溶液 D、澄清石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则 (填“甲”或“乙”)判断正确。
(3)常温下,在测得PH都等于9的NaOH溶液和Na2CO3溶液中,由水电离的OH—浓度分别为amol /L和bmol /L,则a与b的比值= 。
参考答案:HCO3—+H2O  本题解析: 本题解析:
试题分析:甲:升高温度,HCO3—水解程度增大,产生更多的OH-,c(OH-)增大,溶液的碱性增强。水解的两种方程式为:HCO3—+H2O  H2CO3+OH-。乙:酸性:H2CO3>HCO3-。同浓度是酸,溶液的酸性越强,其盐水解的程度越小。因此Na2CO3的水解程度大于NaHCO3的水解程度。(1)A.Ba(OH)2+ Na2CO3=BaCO3↓+2NaOH;Ba(OH)2+NaHCO3= BaCO3↓+H2O+NaOH。都产生白色沉淀。错误。B、BaCl2+ Na2CO3=BaCO3↓+2NaCl。BaCl2与NaHCO3不能发生反应。现象不同,可以鉴别二者。正确。C、NaOH溶液与Na2CO3不发生反应,无现象。NaOH +NaHCO3= Na2CO3+H2O。反应但是无明显现象,不能鉴别二者。错误。D、加入澄清石灰水发生反应:Ca(OH)2+ Na2CO3=CaCO3↓+2NaOH;Ca(OH)2+NaHCO3= CaCO3↓+H2O+NaOH。都产生白色沉淀。错误。因此可以证明乙的观点是正确的。(2)升高温度,盐溶液的pH增大,降低温度,盐溶液的pH又减小,恢复至原来的pH值。这证明甲的观点是正确的。(3)常温下, PH=9的NaOH溶液,a=c(OH-)(水)=c(H+)=10-9mol/L。PH=9的Na2CO3溶液, c(H+)=10-9mol/L, b=c(OH-)(水)=Kw÷c(H+)=10-14÷10-9=10-5mol/L.a:b=10-9mol/L: 10-5mol/L=10-4. H2CO3+OH-。乙:酸性:H2CO3>HCO3-。同浓度是酸,溶液的酸性越强,其盐水解的程度越小。因此Na2CO3的水解程度大于NaHCO3的水解程度。(1)A.Ba(OH)2+ Na2CO3=BaCO3↓+2NaOH;Ba(OH)2+NaHCO3= BaCO3↓+H2O+NaOH。都产生白色沉淀。错误。B、BaCl2+ Na2CO3=BaCO3↓+2NaCl。BaCl2与NaHCO3不能发生反应。现象不同,可以鉴别二者。正确。C、NaOH溶液与Na2CO3不发生反应,无现象。NaOH +NaHCO3= Na2CO3+H2O。反应但是无明显现象,不能鉴别二者。错误。D、加入澄清石灰水发生反应:Ca(OH)2+ Na2CO3=CaCO3↓+2NaOH;Ca(OH)2+NaHCO3= CaCO3↓+H2O+NaOH。都产生白色沉淀。错误。因此可以证明乙的观点是正确的。(2)升高温度,盐溶液的pH增大,降低温度,盐溶液的pH又减小,恢复至原来的pH值。这证明甲的观点是正确的。(3)常温下, PH=9的NaOH溶液,a=c(OH-)(水)=c(H+)=10-9mol/L。PH=9的Na2CO3溶液, c(H+)=10-9mol/L, b=c(OH-)(水)=Kw÷c(H+)=10-14÷10-9=10-5mol/L.a:b=10-9mol/L: 10-5mol/L=10-4.
考点:考查升高温度NaHCO3的水解程度增大的原因、NaHCO3与Na2CO3的鉴定、等pH的碱与盐中水电离程度的比较的知识。
本题难度:困难
3、填空题 (4分)有H+浓度相同、体积相等的三种酸:a、盐酸 b、硫酸 c、醋酸,同
时加入足量的锌,则开始时反应速率由大到小的顺序是 (用
a、b、c表示), 完全反应后生成H2的体积由大到小是 。
参考答案:a=b=c a=b<c
本题解析:
试题分析:盐酸是一元强酸,硫酸是二元强酸,醋酸是一元弱酸,则在氢离子浓度相同的条件下,和锌反应时最初的反应速率是相等的。由于醋酸的浓度最大,所以醋酸产生的氢气最多,而盐酸和硫酸产生的氢气是相等的。
考点:考查外界条件对反应速率的影响以及弱电解质的电离平衡
点评:该题是高考中的常见题型,属于中等难度的试题,试题基础性强,侧重对学生解题方法的培养和训练,有利于培养学生的逻辑思维能力和抽象思维能力,提高学生的灵活应变能力。
本题难度:一般
4、选择题 常温下:pH=13的强碱溶液与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比是
A.11∶1
B.9∶1
C.1∶11
D.1∶9
参考答案:D
本题解析:
试题分析:假设碱的体积为V(碱),酸的体积为V(酸),依题意有: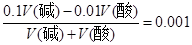 ,解之得: ,解之得: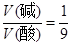
考点:考查酸碱溶液混合。
本题难度:一般
5、选择题 室温时,向20 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生,且混合溶液的体积可看成混合前两溶液的体积之和),下列说法不正确的是:
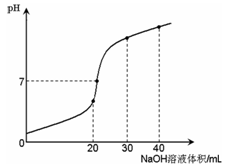
A.PH=7时,溶液中c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
B.当V(NaOH)=20mL时,溶液中水的电离程度比纯水大
C.当V(NaOH)=30mL时,溶液中 c(SO42-)+ c(H+)="=" c(NH3·H2O) + c(OH-)
D.滴加NaOH溶液从30mL至40mL,溶液中Na+与SO42-浓度之和始终为0.1 mol·L-1
参考答案:C
本题解析:
试题分析:A、pH=7时,溶液呈中性,c(OH-)=c(H+),根据电荷守恒,则2c(SO42-)+ c(OH-)=c(H+)+ c(NH4+)+ c(Na+),2c(SO42-)=c(NH4+)+ c(Na+),此时氢氧化钠溶液的体积大于20mL,则c(Na+)>c(SO42-),所以c(SO42-)>c(NH4+),正确;B、当V(NaOH)=20mL时,氢氧化钠与硫酸氢铵的物质的量相同,则生成硫酸钠和硫酸铵的混合液,铵根离子的水解使溶液中水的电离程度比纯水大,正确;C、当V(NaOH)=30mL时,钠离子的物质的量是硫酸根离子或N元素物质的量的1.5倍,根据元素守恒c(Na+)=1.5[c(NH3·H2O)+ c(NH4+)]="1.5" c(SO42-),根据电荷守恒,则2c(SO42-)+ c(OH-)=c(H+)+ c(NH4+)+ c(Na+),所以将钠离子和铵根离子消去,得溶液中0.5 c(SO42-)+ c(H+)="=" c(NH3·H2O) + c(OH-),错误;D、因为硫酸根离子与钠离子都不发生水解反应,原溶液中硫酸根离子与钠离子的浓度相等,都是0.1mol/L,所以无论溶液的体积是多少,二者混合后溶液的总体积是相同的,则溶液中Na+与SO42-浓度之和始终为0.1 mol·L-1,正确,答案选C。
考点:考查电解质溶液混合的计算,离子浓度的比较
本题难度:困难
|