微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (9分)在0.5 mol/L的NaHSO3溶液中滴入石蕊,溶液变红。试回答下列问题:
(1)该溶液中HSO3-的电离程度______(填“大于”、“小于”或“等于”)HSO3-的水解程度。
(2)溶液中Na+、HSO3-、H+、OH-、SO32-等离子的浓度由大到小的顺序为____________。
(3)在Na2SO3溶液中滴入酚酞,溶液变红。若在该溶液中再滴入过量的BaCl2溶液,所观察到的现象是__________________。
参考答案:⑴大于(3分) ⑵c(Na+)>c(HSO3-)>
本题解析:
试题分析:(1)HSO3-水解溶液显碱性,电离溶液显酸性,现溶液能使石蕊,溶液变红,说明电离程度大于水解程度。(2)HSO3-是弱酸离子,不完全电离所以c(Na+)>c(HSO3-),HSO3-  H++ SO32-,又由于水也会电离出H+,故c(H+)>c(SO32-),HSO3-电离使溶液显酸性,水的电离受到了抑制,故c(SO32-)>c(OH-),则有:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)。(3)在Na2SO3溶液中滴入酚酞,溶液变红是因为SO32-水解使溶液显碱性,加入BaCl2溶液,Ba2+和SO32-反应生成白色沉淀BaSO3,SO32-的量减少,溶液的碱性减弱,红色就逐渐褪去,所以现象为:产生白色沉淀,红色褪去。
H++ SO32-,又由于水也会电离出H+,故c(H+)>c(SO32-),HSO3-电离使溶液显酸性,水的电离受到了抑制,故c(SO32-)>c(OH-),则有:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)。(3)在Na2SO3溶液中滴入酚酞,溶液变红是因为SO32-水解使溶液显碱性,加入BaCl2溶液,Ba2+和SO32-反应生成白色沉淀BaSO3,SO32-的量减少,溶液的碱性减弱,红色就逐渐褪去,所以现象为:产生白色沉淀,红色褪去。
考点:水解和电离程度的比较,水解平衡的移动。
本题难度:一般
2、选择题 下列式子中,属于水解反应的是[???? ]
A.H2O+H2O H3O++OH-
H3O++OH-
B.HCO3-+OH-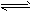 H2O+CO32-
H2O+CO32-
C.CO2+H2O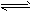 H2CO3
H2CO3
D.CO32-+H2O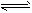 HCO3-+OH-
HCO3-+OH-
参考答案:D
本题解析:
本题难度:简单
3、选择题 下列说法正确的是
A.酸式盐的水溶液一定显碱性
B.醋酸铵溶液呈中性是因为溶液中H+的物质的量和OH-的物质的量相等
C.NaHSO3溶液的PH大于Na2SO4溶液的PH
D.只要酸与碱的物质的量浓度和体积分别相等,它们反应后的溶液就呈中性
参考答案:B
本题解析:
试题解析:一般弱酸的酸式强碱盐水溶液呈碱性,但也有显酸性的,如NaHSO3、NaH2PO4;另外强酸酸式盐水溶液显酸性,如NaHSO4,故A项错;溶液酸碱性取决于溶液中氢离子和氢氧根浓度的相对大小,氢离子浓度等于氢氧根浓度时,溶液呈中性,故B正确;NaHSO3属强碱弱酸盐,水解显酸性pH<7,Na2SO4属强酸强碱盐不水解,溶液显中性pH=7,故C错误;若反应生成的盐能水解,则中和后溶液不一定显中性,故D错误。
考点:溶液的酸碱性
本题难度:一般
4、选择题 盐的水解程度大小可以用“水解度”来表示.关于NaA型盐的水解度,就是已水解的盐的物质的量占原来盐总物质的量的百分数.若测得2L1mol?L-1的强碱弱酸盐NaA溶液的pH为10,则A-离子(A-表示一元酸根离子)的水解度是( ? )
A.0.01%
B.0.1%
C.0.2%
D.1%
参考答案:A
本题解析:
本题难度:一般
5、选择题 广义的水解观认为,无论是盐的水解还是非盐的水解,其最终结果都是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质.根据上述观点,下列说法错误的是( )
A.CaO2的水解产物是Ca(OH)2和H2O2
B.(CH3)3COMgBr的水解产物是(CH3)3COH和Mg(OH)Br
C.PCl3的水解产物是PH3和HClO
D.A1(C2H5)3的水解产物是Al(OH)3与C2H6
参考答案:C
本题解析:
本题难度:简单