微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)
(1)20℃时0.1 mol·L-1NaOH分别滴定0.1 mol·L-1HCl、0.1 mol·L-1CH3COOH的pH变化曲线如下。
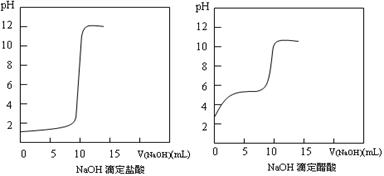
根据上述曲线回答下列问题:
①测得醋酸起点pH为3,则20℃时该浓度醋酸的电离度为 ;
②滴定开始后醋酸曲线变化比盐酸快的原因是 ;
(2)25 ℃时0.1 mol·L-1的H2R水溶液中,用氢氧化钠来调节溶液pH,得到含有H2R、HR-、R2-三种微粒的溶液。当c(Na+)=c(R2-)+c(HR-)+c(H2R)时溶液的溶质为 (填化学式)。
(3)下图是某水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数。
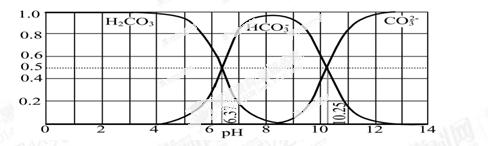
①下列叙述正确的是 。
A.此图是1.0 mol·L-1碳酸钠溶液滴定1.0 mol·L-1 HCl溶液的滴定曲线
B.在pH分别为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-)
C.人体血液的pH约为7.4,则CO2在血液中多以HCO3-形式存在
D.若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为7~9之间
(4)将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵。已知弱电解质在水中的电离平衡常数(25℃)如下表:
弱电解质
| H2CO3
| NH3·H2O
|
电离平衡常数
| Ka1=4.30×10-7 Ka2=5.61×10-11
| 1.77×10-5
现有常温下0.1 mol·L-1的(NH4)2CO3溶液,
①你认为该溶液呈 性(填“酸”、“中”、“碱”),原因是 。
②就该溶液中粒子之间有下列关系式,你认为其中正确的是 。
A.c (NH4+)>c (CO32-)>c (HCO3-)>c (NH3·H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c (CO32-) + c (HCO3-) +c (H2CO3)=0.1 mol·L-1
D.c (NH4+)+ c (NH3·H2O)=2 c (CO32-) + 2c (HCO3-) +2 c (H2CO3)
参考答案:(1)1% 醋酸是弱酸,中和生成的醋酸
本题解析:
试题解析:(2)①根据图象可知0.1mol?L-1的醋酸,其PH为3,所以c(H+)=10-3mol/L,故电离度=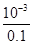 ×100%=1%;②醋酸是弱酸,醋酸与氢氧化钠反应生成CH3COO-;使电离平衡逆移CH3COOH?CH3COO-+H+,故H+浓度变化比较快,故答案为:醋酸是弱酸,中和反应生成的醋酸根离子对醋酸的电离产生抑制;(2)25℃时0.1mol?L-1的H2R水溶液中,用氢氧化钠来调节溶液pH,得到含有H2R、HR-、R2-三种微粒的溶液,溶液中存在c(Na+)=c(R2-)+c(HR-)+c(H2R),说明钠原子和R原子以1:1存在于盐溶液中,R形成的酸为二元酸,所以该溶质为二元酸的酸式盐,即NaHR,故答案为:NaHR;(3)①A.1.0mol/L碳酸钠溶液滴定1.0mol/LHCl溶液,在碳酸浓度达到饱和之前,碳酸浓度应逐渐增大,且起始浓度不可能为1.0mol/L,故A错误;B.由图可知,pH为6.37时c(H2CO3)=c(HCO3-),pH为10.25时,c(HCO3-)=c(CO32-),但三者的浓度不相等,故B错误;C.由图可知,pH为7.4时,HCO3-的最大,则当人体血液的pH约为7.4,则CO2在血液中多以HCO3-的形式存在,故C正确;D.溶液的pH为7~9之间时,溶液中的阴离子主要以HCO3-形式存在,所以溶液中的溶质主要为碳酸氢钠,故D正确;故选CD;(4)①分析电离平衡常数可知电离程度,NH3?H2O>H2CO3>HCO3-,对应盐水解程度NH4+<HCO3-<CO32-,常温下0.1mol?L-1的(NH4)2CO3溶液呈碱性,由于NH3?H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液中c (OH-)>c(H+),溶液呈碱性;②A.溶液中铵根离子浓度大于碳酸根离子浓度,碳酸根离子水解程度大于铵根离子水解程度,所以溶液中离子浓度大小为:c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3?H2O),故A正确;B.溶液中存在电荷守恒为:c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),故错误;C.依据溶液中物料守恒得到:c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol?L-1 ,故C正确;D.依据溶液中物料守恒,n(N):n(C)=2:1,结合溶液中离子种类和守恒关系得到:c(NH4+)+c(NH3?H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故D正确;故答案为:ACD. ×100%=1%;②醋酸是弱酸,醋酸与氢氧化钠反应生成CH3COO-;使电离平衡逆移CH3COOH?CH3COO-+H+,故H+浓度变化比较快,故答案为:醋酸是弱酸,中和反应生成的醋酸根离子对醋酸的电离产生抑制;(2)25℃时0.1mol?L-1的H2R水溶液中,用氢氧化钠来调节溶液pH,得到含有H2R、HR-、R2-三种微粒的溶液,溶液中存在c(Na+)=c(R2-)+c(HR-)+c(H2R),说明钠原子和R原子以1:1存在于盐溶液中,R形成的酸为二元酸,所以该溶质为二元酸的酸式盐,即NaHR,故答案为:NaHR;(3)①A.1.0mol/L碳酸钠溶液滴定1.0mol/LHCl溶液,在碳酸浓度达到饱和之前,碳酸浓度应逐渐增大,且起始浓度不可能为1.0mol/L,故A错误;B.由图可知,pH为6.37时c(H2CO3)=c(HCO3-),pH为10.25时,c(HCO3-)=c(CO32-),但三者的浓度不相等,故B错误;C.由图可知,pH为7.4时,HCO3-的最大,则当人体血液的pH约为7.4,则CO2在血液中多以HCO3-的形式存在,故C正确;D.溶液的pH为7~9之间时,溶液中的阴离子主要以HCO3-形式存在,所以溶液中的溶质主要为碳酸氢钠,故D正确;故选CD;(4)①分析电离平衡常数可知电离程度,NH3?H2O>H2CO3>HCO3-,对应盐水解程度NH4+<HCO3-<CO32-,常温下0.1mol?L-1的(NH4)2CO3溶液呈碱性,由于NH3?H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液中c (OH-)>c(H+),溶液呈碱性;②A.溶液中铵根离子浓度大于碳酸根离子浓度,碳酸根离子水解程度大于铵根离子水解程度,所以溶液中离子浓度大小为:c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3?H2O),故A正确;B.溶液中存在电荷守恒为:c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),故错误;C.依据溶液中物料守恒得到:c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol?L-1 ,故C正确;D.依据溶液中物料守恒,n(N):n(C)=2:1,结合溶液中离子种类和守恒关系得到:c(NH4+)+c(NH3?H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故D正确;故答案为:ACD.
考点:中和滴定;盐类的水解
本题难度:困难
2、选择题 常温下,将0.06mol/L的H2SO4溶液和0.10mol/L的NaOH等体积混合后,溶液的PH为
A:1.7 B:2.0 C:12.0 D:12.3
参考答案:C
本题解析:略
本题难度:一般
3、选择题 水的电离过程为H2O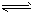 H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×1014, H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×1014,
K(35℃)=2.1×10 -14。则下列叙述正确的是[???? ]
A.c(H+)随温度的升高而降低
B.在35℃时,c(H+)>c(OH-)
C.水的电离百分率a(25℃)>a(35℃)
D.水的电离是吸热的
参考答案:D
本题解析:
本题难度:一般
4、选择题 现有室温下两种溶液,有关叙述正确的是
编号
| ①
| ②
| pH
| 12
| 2
| 溶液
| 氢氧化钠溶液
| 醋酸溶液
A.两种溶液中水的电离程度:①=②
B.两种溶液的浓度:c(NaOH)
参考答案:
本题解析:
本题难度:一般
5、填空题 按要求进行书写:
(1)氯化钡的电离方程式:______;
(2)氢氧化亚铁在空气中被氧化的化学方程式:______;
(3)过氧化钠与水反应的化学方程式:______;
(4)在化学方程式上用双线桥法表示电子转移的方向及数目:MnO2+4HCl(浓) △
.
MnCl2+2H2O+Cl2↑.
参考答案:(1)氯化钡在水中电离生成钡离子和氯离子,电离方程式为:Ba
本题解析:
本题难度:一般
|
|
网站客服QQ: 960335752 - 14613519 - 791315772
|