微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关于胶体的说法正确的是
①胶体是一种均一、透明、稳定的分散系
②利用丁达尔效应可以区别溶液与胶体
③FeCl3溶液可以止血是电解质溶液使胶体聚沉
④制备Fe(OH)3胶体的离子方程式为:Fe3++3H2O Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
⑤可用渗析的方法除去淀粉溶液中的NaCl
⑥胶体能够稳定存在的主要原因是胶体带电
⑦直径介于1nm~100nm之间的微粒称为胶体
⑧向Al(OH)3胶体中加入NaOH溶液至过量,先有沉淀产生,后沉淀溶解.
A.①②③⑤⑧
B.①②④⑥
C.②③⑤⑦
D.①④⑤⑦
参考答案:A
本题解析:分析:①胶体是一种均一、透明、稳定的分散系;
②胶体能发生丁达尔效应;
③胶体遇电解质溶液能产生聚沉;
④书写胶体的离子方程式时Fe(OH)3不是沉淀;
⑤胶体能透过滤纸但不能透过半透膜;
⑥胶体能够稳定存在的主要原因是胶粒带电;
⑦胶体中分散质粒子直径在1-100nm之间;
⑧NaOH溶液是电解质能使胶体发生聚沉生成Al(OH)3沉淀,继续滴加Al(OH)3沉淀可与氢氧化钠反应生成偏铝酸钠,沉淀溶解.
解答:①胶体是一种均一、透明、稳定的分散系,故①正确;
②胶体有丁达尔效应,溶液无丁达尔效应,故②正确;
③血液是胶体,FeCl3溶液是电解质,电解质溶液可以使胶体聚沉,故③正确;
④书写胶体的离子方程式时Fe(OH)3不是沉淀,正确是的:Fe3++3H2O Fe(OH)3+3H+,故④错误;
Fe(OH)3+3H+,故④错误;
⑤氯化钠溶液能透过半透膜而胶体不能,故可用渗析的方法除去淀粉溶液中的NaCl,故⑤正确;
⑥胶体能够稳定存在的主要原因是胶粒带电,胶体呈电中性,故⑥错误;
⑦分散质粒子直径介于1nm~100nm之间的分散系称为胶体,故⑦错误;
⑧NaOH溶液是电解质能使胶体发生聚沉生成Al(OH)3沉淀,继续滴加Al(OH)3沉淀可与氢氧化钠反应生成偏铝酸钠,沉淀溶解,故⑧正确.
故选A.
点评:本题考查胶体的性质,难度不大,平时注意知识的积累.
本题难度:简单
2、选择题 100℃时,KCl溶液中溶质的物质的量浓度为C1.降至室温后析出m?g?KCl晶体(晶体中不含结晶水),所得溶液中溶质的物质的量浓度为C2,则下列说法不正确的是
A.一定条件下,KCl的溶解度是有限的
B.溶液中KCl的物质的量浓度C1一定大于C2
C.降温前后,溶液中KCl的物质的量未发生改变
D.降温过程中,结晶和溶解的速率可能出现相等
参考答案:C
本题解析:分析:溶液中固体的溶解和结晶为可逆过程,降至室温后析出mgKCl晶体,说明随着温度的降低,溶解度降低,由于溶液体积不变,则溶液的质量分数,物质的量浓度都减小,以此解答该题.
解答:A.不同温度下,KCl的溶解度不同,且溶剂不同,溶解度也不同,故A正确;
B.降至室温后析出mgKCl晶体,由于溶液体积不变,物质的量浓度减小,故B正确;
C.降至室温后析出mgKCl晶体,溶液中KCl的物质的量分数改变,故C错误;
D.溶液中固体的溶解和结晶为可逆过程,当达到平衡时,结晶和溶解的速率相等,故D正确.
故选C.
点评:本题考查溶液的物质的量浓度大比较、溶解度等问题,题目难度不大,注意把握饱和溶液的特点以及影响溶解平衡的因素.
本题难度:简单
3、选择题 一些食品包装中常放入生石灰做干燥剂,该物质属于
A.酸
B.碱
C.盐
D.氧化物
参考答案:D
本题解析:分析:生石灰的主要成分是CaO,只有两种元素组成,且有一种为氧元素,应为氧化物.
解答:根据物质的定义区分:
酸:在水溶液中电离出的阳离子全部是氢离子的化合物叫做酸;
碱:在水溶液中电离出的阴离子全部是氢氧根离子的化合物叫做碱;
盐:含有金属离子(或铵根)与酸根的化合物叫做盐;
氧化物:由两者元素组成,其中已知为氧元素的化合物叫做氧化物.
生石灰的主要成分是CaO,只有两种元素组成,且有一种为氧元素,应为氧化物.
故选D.
点评:本题考查物质的分类,题目难度不大,注意物质的分类角度和物质的性质.
本题难度:简单
4、选择题 设NA为阿伏加德罗常数的值,下列有关叙述不正确的是
A.标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为NA
B.1mol羟基(-OH)所含的电子总数为9NA
C.14g乙烯、丙烯的混合气体中所含原子总数为3NA
D.0.5mol1,3-丁二烯分子中含有C=C双键数为NA
参考答案:A
本题解析:分析:A、标准状况下,庚烷是液体不能使用气体摩尔体积;
B、1个羟基含有9个电子,根据N=nNA计算电子数;
C、乙烯、丙烯最简式相同为CH2,根据n=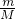 计算最简式的物质的量,再根据N=nNA计算原子数;
计算最简式的物质的量,再根据N=nNA计算原子数;
D、1,3-丁二烯分子中含有2个C=C双键,根据N=nNA计算C=C双键数.
解答:A、标准状况下,庚烷是液体,不能使用气体摩尔体积22.4L/mol,故A错误;
B、1个羟基含有9个电子,1mol羟基(-OH)所含的电子总数为1mol×9×NAmol-1=9NA,故B正确;
C、乙烯、丙烯最简式相同为CH2,最简式的物质的量为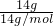 =1mol,所以14g乙烯、丙烯的混合气体中所含原子总数为1mol×3×NAmol-1=3NA,故C正确;
=1mol,所以14g乙烯、丙烯的混合气体中所含原子总数为1mol×3×NAmol-1=3NA,故C正确;
D、1,3-丁二烯分子中含有2个C=C双键,0.5mol1,3-丁二烯分子中含有C=C双键数为0.5mol×2×NAmol-1=NA,故D正确.
故选A.
点评:本题考查阿伏伽德罗常数的有关计算,难度不大,注意气体摩尔体积的使用范围与条件.
本题难度:简单
5、选择题 下列溶液中Cl-浓度与50mL?1mol?L-1?AlCl3溶液中Cl-的物质的量浓度相等的是
A.150?mL?3?mol?L-1的NaCl溶液
B.75?mL?2?mol?L-1?NH4Cl溶液
C.150?mL?1?mol?L-1的KCl溶液
D.75?mL?4?mol?L-1的FeCl3溶液
参考答案:A
本题解析:分析:根据溶液中氯离子的物质的量浓度=盐的浓度×化学式中氯离子个数,据此分析解答.
解答:50mL?1mol?L-1的AlCl3溶液中Cl-物质的量浓度是3mol/L,
A、150?mL?3?mol?L-1的NaCl溶液中c(Cl-)=3?mol?L-1×1=3mol/L,故A正确;
B、75?mL?2?mol?L-1?NH4Cl溶液中c(Cl-)=2?mol?L-1×1=2mol/L,故B错误;
C、150mL1?mol?L-1的KCl溶液中c(Cl-)=1mol?L-1×1=1mol/L,故C错误;
D、75mL?4mol?L-1的FeCl3溶液中c(Cl-)=4mol?L-1×3=12mol/L,故D错误;
故选A.
点评:本题考查了溶液中氯离子物质的量浓度的计算,难度不大,溶液中氯离子的物质的量浓度为盐的浓度与化学式中离子个数的积.
本题难度:一般