微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 硫、氮、稀土元素的单质和化合物应用广泛。
Ⅰ.(1)将硫铁矿和焦炭放在炼硫炉中,在有限空气中燃烧,发生下列反应:
3FeS2 + 12 C + 8O2 = Fe3O4 + 12CO + 6S
生成3mol硫时,被氧化的物质物质的量为__????????????? _________。
(2)过硫酸钾化学式为:K2S2O8,过硫酸结构式为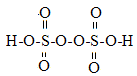
①过硫酸钾和过硫酸均有强氧化性,不稳定,容易分解,如2H2S2O8=2H2SO4+2SO3+O2
下列能加快过硫酸分解的固体物质是?????????????????????。
A.CuO
B.MnO2
C.Fe2O3
D.NaNO3
②已知硫酸锰(MnSO4)和过硫酸钾两种盐溶液在催化剂存在下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸。请写出上述反应的化学方程式:____________???????__________。
③若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有_________________。
Ⅱ.稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解,由CeCl3·6H2O制备无水CeCl3应采取的措施是?????????????????????????????? _??????????????????????????????????????????_。
参考答案:Ⅰ.(1)7.5mol (2分)
(2)①ABC(全对
本题解析:
试题分析:Ⅰ.(1)从化学方程式可看出Fe、S、C三种元素的化合价均升高,所以被氧化的物质为FeS2和C,生成3mol硫时,被氧化的FeS2为1.5mol,被氧化的C为6mol硫,共7.5mol。(2) ①类比CuO、MnO2、Fe2O3对过氧化氢分解的催化作用可做出判断;②反应后生成H2SO4说明有水参加反应,根据化合价变化情况配平后即得化学方程式:8H2O + 2MnSO4 + 5K2S2O8 = 2KMnO4 + 4K2SO4 + 8H2SO4;③K2S2O8氧化性比KMnO4强,可把Cl–
本题难度:一般
2、选择题 已知实验室中,可用Co2O3代替MnO2来制备氯气,反应前后存在的六种微粒分别是:Co2O3、H2O、Cl2、H+、Cl-和Co2+。下列叙述不正确的是
A.Cl2发生还原反应
B.氧化剂与还原剂的物质的量之比为1︰2
C.若反应中生成3molH2O,则转移电子2mol
D.理论上利用该反应可以将化学能转化为电能
参考答案:A
本题解析:
试题分析:
氧化还原反应化合价有升必有降,由反应前后存在的六种微粒和知,反应方程式为Co2O3+6HCl==2CoCl2+Cl2+3H2O,Cl2是氧化产物,Co2O3发生还原反应,A项错误;Co2O3是氧化剂,HCl是还原剂,且1/3起还原作用,氧化剂与还原剂的物质的量之比为1︰2,B项正确;C项正确;理论上利用氧化还原反应都可以将化学能转化为电能,D项正确。
点评:本题实际上是利用了类比的思想,原来二氧化锰是做氧化剂,所以后面的替代物也是作为氧化剂,盐酸的作用没有发生改变,转移电子
本题难度:简单
3、选择题 在下列变化中,需要加入合适的还原剂才能实现的是?????????????????
A.H2→HCl
B.CO→CO2
C.FeCl3→ FeCl2
D.SO2→SO3
参考答案:C
本题解析:略
本题难度:一般
4、填空题 (6分)一个完整的氧化还原反应方程式可以拆开写成两个“半反应式”,一个是“氧化反应”式,一个是“还原反应”式。如 的拆写结果是
的拆写结果是 :氧化反应为:
:氧化反应为: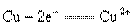 ;还原反应为:
;还原反应为: 。
。
①请据此将反应:Fe + 4H+ + NO3- = Fe3+ + NO↑ + 2H2O拆写成两个“半反应式”:氧化反应为__________________????????????__;还原反应为__________?????????__________。
②已知某一氧化还原反应为:CH4+ 2OH- + 2O2 = CO32- + 3H2O;其中氧化反应的半反应可写为: ,则还原反应的半反应可写为___________________?。
,则还原反应的半反应可写为___________________?。
参考答案: 本题解析:略
本题解析:略
本题难度:一般
5、填空题 某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2
(1)该反应中的还原剂是???????????????????????????????。
(2)写出该反应方程式并配平??????????????????????????????????。
(3)如果反应转移了0.3 mol电子,则产生的气体在标准状况下的体积为??????????????????。
参考答案:(1)H2O2????(2)2H2CrO4 +3H2O2 =
本题解析:(1)双氧水生成氧气,氧元素的化合价升高,失去电子,被氧化,所以双氧水是还原剂。
(2)双氧水生成氧气的过程是被氧化的过程,即双氧水作还原剂,所以铬酸是氧化剂,因此反应的方程式是3H2O2+2H2CrO4=3O2↑+2Cr(OH)3+2H2O。
(3)根据方程式可知,反应中转移6个电子,所以如反应转移了0.3mol电子,则产生的气体是0.15mol,标准状况下的体积是0.15mol×22.4L/mol=3.36L。
本题难度:一般