微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
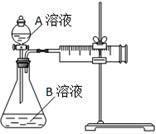
实验序号
| A溶液
| B溶液
|
①
| 20 mL 0.1 mol·L-1H2C2O4溶液
| 30 mL 0.01 mol·L-1KMnO4溶液
|
②
| 20 mL 0.2 mol·L-1H2C2O4溶液
| 30 mL 0.01 mol·L-1KMnO4溶液
(1)该实验探究的是??????因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是??????>??????(填实验序号)。
(2)若实验①在2 min末收集了4.48 mL CO2(标准状况下),则在2 min末,c(MnO4-)=_______mol·L-1。(假设混合溶液体积为50 mL)
(3)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定??????来比较化学反应速率。
(4)小组同学发现反应速率总是如下图,其中t1~t2时间内速率变快的主要原因可能是:①产物Mn2+是反应的催化剂、②??????。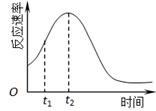
2、填空题 在2L密闭容器中充入1mol H2和1mol I2蒸气,压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)==2HI(g)???? △H<0达到平衡时候n(H2)为0.8mol
(1) 保持容器容积不变,向其中加入1molH2,反应速率???????????????(填加快、减慢、不变、不确定),理由是???????????????????????????????????????????????。
(2) 保持容器气体压强不变,向其中加入1molHe,反应速率???????????????(填加快、减慢、不变、不确定),理由是???????。平衡???????????????(正向或逆向或不)移动
(3)计算该温度下的平衡常数
3、选择题 可逆反应H2(g)+I2(g)?

2HI(g)达到平衡状态时的标志是( )
A.混合气体的体积恒定不变
B.混合气体的颜色不再改变
C.H2,I2,HI的浓度相等
D.I2的生产速率等于H2的生产速率
4、选择题 在一定温度下,反应1/2H2(g)+ 1/2X2(g) 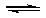 HX(g)的平衡常数为10。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于 HX(g)的平衡常数为10。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于

A.5%
B.17%
C.25%
D.33%
5、填空题 在体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g)十H2O(g) 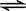 ?CO2(g)十H2 (g)????△H<0?, CO和H2O浓度变化如下图, ?CO2(g)十H2 (g)????△H<0?, CO和H2O浓度变化如下图,
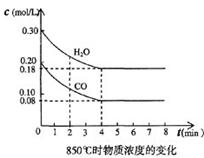
(1) 3min—4min之间反应处于____状态(填平衡、不平衡);
(2)要使反应在8min后,平衡向逆方向移动,可采取的措施是__? ___,要使反应在8min后,反应速率降低,平衡向正方向移动,可采取的措施是________。(填a,b,c,d)
a.增加水蒸气? b.降低温度 ??c.使用催化剂? d.增加氢气浓度
(3)求出850℃ 时,该反应的平衡常数和CO的平衡转化率(写出详细计算过程)
|