微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 可逆反应2SO2+O2?

?2SO3在密闭容器中达到了平衡,下列说法正确的是( )
A.SO2和O2不再化合,反应停止了
B.容器内压强保持不变
C.SO2、O2和SO3的浓度相等
D.SO2、O2和SO3的物质的量之比为2:1:2
2、选择题 在一定条件下,反应?2SO2(g)+O2(g)

2SO3(g)达到最大限度时,下列说法正确的是( )
A.反应完全停止,不再继续进行
B.混合物中SO2、O2、SO3的分子数比为2:1:2
C.等温等压下,气体的体积为开始时的三分之二
D.反应混合物的平均摩尔质量不再改变
3、填空题 (1)钒触媒(V2O5)能加快SO2的氧化速率,此过程中SO2先与V2O5反应生成V2O4。该过程的化学方程式可表示为__________________________________________。
(2)为测定过程中混合气的SO2体积分数,选用0.0500 mol/L I2的标准溶液、淀粉溶液进行测定。已知:V(耗用I2标准溶液)="10.00" mL,V(采集烟气)="100.0" mL(已折算为标准状况),则烟气中SO2?的体积分数为_____________________。
(3)一定温度时,SO2的平衡转化率(α)与体系总压强(p)的关系如图9所示。试分析工业生产中采用常压的原因是____________________。
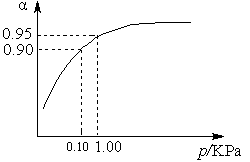
图9
(4)在温度相同、体积均为1 L的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下。
已知:2SO2(g)+O2(g) 2SO3(g)??ΔH ="-98.3" kJ·mol-1。
2SO3(g)??ΔH ="-98.3" kJ·mol-1。
容?器
| 甲
| 乙
| 丙
|
反应物投入量
| 2 mol SO2、1 mol O2
| 2 mol SO3
| m mol SO2、n mol O2、
p mol SO3
|
c(SO3) /mol·L-1
| 1.4
| 1.4
| 1.4
|
能量变化
| 放出a kJ
| 吸收b kJ
| 吸收c kJ
|
SO2或SO3的转化率
| α1
| α2
| 12.5%
?
则:α1+α2=_________________,p=________________mol,b+c=_______________kJ。
4、选择题 在一定温度下,可逆反应A(g)+3B(g)?2C(g)达到平衡状态的标志是( )
A.C生成的速率与A分解的速率相等
B.单位时间生成nmolA,同时生成3nmolB
C.A、B、C的浓度不再变化
D.A、B、C的分子数比为1:3:2
5、填空题 汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致: N2(g)+O2(g)?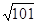 2NO(g) ΔH>0,已知该反应在2 404 ℃ 时,平衡常数K=64×10-4。请回答: 2NO(g) ΔH>0,已知该反应在2 404 ℃ 时,平衡常数K=64×10-4。请回答:
(1)某温度下,向2L的密闭容器中充入N2和O2各1mol,5分钟后O2的物质的量为0.5mol,则N2的反应速率________。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志________。
A.消耗1 mol N2同时生成1 mol O2
B.混合气体密度不变
C.混合气体平均相对分子质量不变
D.2v(N2)正=v(NO)逆
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是________(填字母序号)。
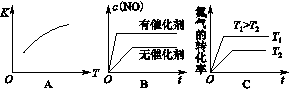
(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数______。(填“变大、“变小”或“不变”)
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,此时反应___________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是____
|