微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 (6分)将6 mol H2和3 mol CO充入容积为1 L的密闭容器中,进行如下反应:2 H2(气) + CO(气) 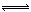 CH3OH(气),6秒时体系达到平衡,此时容器内压强为开始时的0.6倍,求:(1)H2的反应速率;(2)CO的转化率;(3)求相同条件下CH3OH(气)
CH3OH(气),6秒时体系达到平衡,此时容器内压强为开始时的0.6倍,求:(1)H2的反应速率;(2)CO的转化率;(3)求相同条件下CH3OH(气) 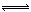 2 H2(气) + CO(气)的平衡常数K
2 H2(气) + CO(气)的平衡常数K
参考答案:2 H2(气) + CO(气)  本题解析:考查可逆反应的有关计算。
本题解析:考查可逆反应的有关计算。
本题难度:一般
2、填空题 (10分)高炉炼铁过程中发生的主要反应为:1/3Fe2O3(s)+CO(g) 2/3Fe(s)+CO2(g)
2/3Fe(s)+CO2(g)
温度/℃
| 1000
| 1150
| 1300
|
平衡常数
| 4.0
| 3.7
| 3.5
已知该反应在不同温度下的平衡常数如下:
请回答下列问题:
(1)该反应的平衡常数表达式K=??????,△H??????0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过l0 min后达到平衡。求该时间范围内反应的平均反应速率υ(CO2)=??????、CO的平衡转化率= ???????:
(3)欲提高(2)中CO的平衡转化率,可采取的措施是??????。
A.减少Fe的量????? B.增加Fe2O3的量???? C.移出部分CO2
D.提高反应温度??? E.减小容器的容积????? F.加入合适的催化剂
参考答案:⑴c(CO2)/ c(CO)(2
本题解析:(1)平衡常数是指在一定条件下的可逆反应中,当达到平衡状态时,生成物浓度的幂之积和反应物难得的幂之积的比值,所以其表达式为K=c(CO2)/ c(CO)。根据有关数据可知,温度越高平衡常数越小,所以升高温度,平衡向逆反应方向移动,即正反应是放热反应。
(2)设平衡时CO的物质的量浓度是x,则消耗CO的浓度是0.1-x,生成CO2也是0.1-x,平衡是CO2就是0.1-x+0.1=0.2-x。根据平衡常数可知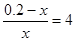 ??????????,解得x=0.04mol/L,所以消耗CO是0.1mol/L-0.04mol/L=0.06mol/L,则其转化率是0.06÷0.1×1005=60%。CO2的反应速率是0.06mol/L÷10min=6×10-3mol/(L·min)。 ??????????,解得x=0.04mol/L,所以消耗CO是0.1mol/L-0.04mol/L=0.06mol/L,则其转化率是0.06÷0.1×1005=60%。CO2的反应速率是0.06mol/L÷10min=6×10-3mol/(L·min)。
(3)固体质量的变化,不影响平衡状态,AB不正确。C是解得生成物浓度,平衡向正反应方向移动,转化率增大。正反应放热,升高温度平衡向逆反应方向移动,转化率降低。反应前后体积不变,改变压强,平衡不移动。同样催化剂也不能影响平衡状态,所以正确的答案是C。
本题难度:一般
3、填空题 (1)t℃时,将2molSO2和1mol O2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2 (g)+O2 (g) 2SO3 (g);ΔH=-196kJ·mol-1。2min时反应达到化学平衡,此时测得反应放出的热量为39.2kJ。请填写下列空白:①下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)????? 2SO3 (g);ΔH=-196kJ·mol-1。2min时反应达到化学平衡,此时测得反应放出的热量为39.2kJ。请填写下列空白:①下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)?????
??A.容器内压强不再发生变化?????????? B.SO2的体积分数不再发生变化?
C.容器内气体质量不再发生变化?????? D.容器内气体密度不再发生变化?
②从反应开始至达到化学平衡,生成SO3平均反应速率为??????;该条件下反应的平衡常数K=?????(精确到小数点后两位)?
③反应达到化学平衡后,以下操作将引起平衡向正反应方向移动并能提高SO2转化率的是??????????????
A.向容器中通入少量O2????????????? B.向容器中通入少量SO2?
C.使用催化剂?????????????????????? D.降低温度?
E.向容器中通入少量氦气?
④上述反应达平衡后,判断下列情况下平衡移动的方向(填“向右”、“向左”或“不移动).?
再通入1.6molSO2、0.8molO2、0.4molSO3,????;再通入0.2molSO2、0.2molSO3,_____?????????
(2)工业生产中产生含SO2的废气,经石灰吸收和氧化后制成硫酸钙,硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、水泥等。已知25℃时,Ksp(CaSO4)=7.10×10-5。向0.100 L含CaSO4固体的溶液中加入2.22 gCaCl2 粉末充分搅拌,假设溶液的体积变化忽略不计,则溶液中CaSO4固体的质量将??(填“增大”、“减小”或“不变”,下同),Ksp(CaSO4)将______ 。
参考答案:(1) ① AB? (2分)? ②0.1mol·L-1·mi
本题解析:略
本题难度:一般
4、选择题 在一定温度下的定容密闭容器中,当下列物理量不再变化时,表明反应:A(s)+2B(g) C(g)+D(g)已达到平衡状态的是 C(g)+D(g)已达到平衡状态的是
①混合气的压强???????②混合气的密度???????③气体的总物质的量
④混合气的平均分子量????⑤混合气的总质量??????⑥B的物质的量浓度
A .①②④⑤?????????????? B.②④⑤⑥?????????????? C.②③⑤⑥?????????????? D.①②③④ .①②④⑤?????????????? B.②④⑤⑥?????????????? C.②③⑤⑥?????????????? D.①②③④
参考答案:B
本题解析:略
本题难度:一般
5、选择题 一定条件下,在体积为10L的密闭容器中,1 mol X和1 mol Y进行反应:
2X(g)+Y(g)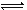 Z(g),经60s达到平衡,生成0.3 mol Z,下列正确的是(???? ) Z(g),经60s达到平衡,生成0.3 mol Z,下列正确的是(???? )
A.60s里以X浓度变化表示的反应速率为0.001 mol/(L·s)
B.将容器体积变为20 L,Z的平衡浓度变为原来的1/2
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则正反应的DH>0
参考答案:A
本题解析:经60s达到平衡,生成0.3 mol Z,所以用Z表示的反应速率为
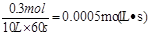 。因为速率之比是相应的化学计量数之比,所以以X浓度变化表示的反应速率为以X浓度变化表示的反应速率为0.0005 mol/(L·s)×2=0.001 mol/(L·s),A正确。增大容器的体积,压强减小,平衡向逆反应方向移动,所以Z的平衡浓度小于原来的1/2,B不正确。增大压强,平衡向正反应方向移动,反应物的转化率增大,C不正确。升高温度,X的体积分数增大,说明平衡向逆反应方向移动,所以正反应是放热反应,D不正确。答案选A。 。因为速率之比是相应的化学计量数之比,所以以X浓度变化表示的反应速率为以X浓度变化表示的反应速率为0.0005 mol/(L·s)×2=0.001 mol/(L·s),A正确。增大容器的体积,压强减小,平衡向逆反应方向移动,所以Z的平衡浓度小于原来的1/2,B不正确。增大压强,平衡向正反应方向移动,反应物的转化率增大,C不正确。升高温度,X的体积分数增大,说明平衡向逆反应方向移动,所以正反应是放热反应,D不正确。答案选A。
本题难度:简单
|