微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一密闭容器中充入1molNO2气体,建立如下平衡2NO2  ??N2O4,测得NO2转化率为a%。在温度、体积不变时,再通入1molNO2,待新平衡建立时,测得NO2的转化率为b%,? a与b比较?????????????????????????????????????????
??N2O4,测得NO2转化率为a%。在温度、体积不变时,再通入1molNO2,待新平衡建立时,测得NO2的转化率为b%,? a与b比较?????????????????????????????????????????
A.a>b
B.b>a
C.a=b
D.无法比较
参考答案:B
本题解析:
试题分析:第一次达平衡后,再加入NO2,由于该容器是一个固定容积的密闭容器,所以加入NO2后,反应体系的压强增大;增大压强,化学平衡向气体体积减小的方向移动,所以平衡向正反应方向移动,NO2的转化率增大,即b>a,答案选B。
点评:本题以二氧化氮和四氧化二氮的可逆反应为载体考查了化学平衡移动原理,要注意:压强只对反应前后气体体积改变的可逆反应平衡移动有影响,对反应前后气体体积不变化的可逆反应无影响,但压强对所有有气体参加的可逆反应反应速率都有影响,无论反应前后气体体积是否变化。
本题难度:简单
2、选择题 一定条件下,向容积为2L的密闭容器中充入l mol CO2和3 molH2,发生如下反应:
 ,5 min后反应达到平衡时c(CH3OH)为0.2 mol
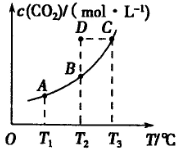
,5 min后反应达到平衡时c(CH3OH)为0.2 mol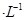 。CO2(g)的平衡物质的量浓度c(CO2)与温度关系如图所示。下列说法错误的是
。CO2(g)的平衡物质的量浓度c(CO2)与温度关系如图所示。下列说法错误的是
A. 0~5 min,CO2的平均反应速率为0.04 mol.(L.min)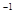
B.反应
C.在T2℃时,若反应处于状态D,则一定有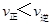
D.若T1℃、T2℃时的平衡常数分别为K1、K2,则K1>K2
参考答案:C
本题解析:
试题分析:A. 5 min后反应达到平衡时c(CH3OH)为0.2 mol/L,则反应消耗的CO2浓度变化Δc(CO2)=" 0.2" mol/L。所以V(CO2)=Δc(CO2)÷Δt="0.2" mol/L÷5 min=0.04mol/(L·min).正确。B.由CO2平衡浓度与温度的关系可知:升高温度CO2浓度增大,说明升高温度排布向逆反应方向移动。根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,所以正反应是放热反应。ΔH<0. C.在T2℃时,若反应处于状态D,由于CO2浓度大于该温度的平衡浓度,所以反应向消耗CO2的方向移动。即向正反应方向移动。一定有V正>V逆。错误。D.若T1℃、T2℃时的平衡常数分别为K1、K2,由于该反应的正反应为放热反应,升高温度,平衡逆向移动,T1℃<T2℃则K1>K2。正确。
本题难度:一般
3、选择题 可逆反应aA(g) + bB(g)  ?cC(g) + dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是
?cC(g) + dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是
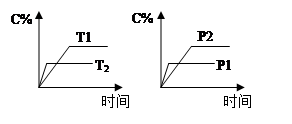
A.达平衡后,若升温,平衡左移
B.达平衡后,加入催化剂则C%增大
C.化学方程式中a+b>c+d
D.达平衡后,减少A的量有利于平衡向右移动
参考答案:A
本题解析:
试题分析:A、温度T2首先达到平衡状态,说明反应速率快,因此温度是T2大于T1。温度高C的百分含量低,说明升高温度平衡向逆反应方向移动,正方应是放热反应,A正确;B、催化剂只能改变反应速率,而不能改变平衡状态,所以达平衡后,加入催化剂C%不变,B不正确;C、压强P1首先达到平衡状态,说明P1大于P2,压强高C的百分含量低,说明增大压强平衡向逆反应方向移动,正方应是体积增大的可逆反应,因此a+b<c+d,C不正确;D、达平衡后,减少A的量平衡不移动,因为浓度改变才能影响平衡状态,D不正确,答案选A。
本题难度:一般
4、填空题 (11分)反应①Fe(s)+CO2(g) FeO(s)+CO(g)△H=akJ·mol—1,平衡常数为K;反应②CO(g)+1/2O2(g)=CO2(g)?△H=bkJ·mol—1
FeO(s)+CO(g)△H=akJ·mol—1,平衡常数为K;反应②CO(g)+1/2O2(g)=CO2(g)?△H=bkJ·mol—1
测得在不同温度下,K值如下:
温度/℃
| 500
| 700
| 900
|
K
| 1.00
| 1.47
| 2.40
(1)若500℃时进行反应①,CO2起始浓度为2mol·L—1,CO的平衡浓度为_____________。
(2)反应①中的a__________0(填大于、小于、等于)。
(3)700℃反应①达到平衡,要使得该平衡向右移动,其它条件不变时,可以采取的措施有__________(填序号)
A.缩小反应器体积??????????????????????????? B.通入CO2
C.升高温度到900℃?????????????????? D.使用合适的催化剂
(4)下列图像符合反应①的是___________(填序号)(图中 是速率、 是速率、 为混合物中CO含量,T为温度且T1>T2) 为混合物中CO含量,T为温度且T1>T2)

(5)由反应①和②可求得,反应2Fe(s)+O2(g)=2FeO(s)的△H=__________。
参考答案:(1)1mol·L—1(2分)??(2)大于(2分)
本题解析:略
本题难度:一般
5、选择题 用CO合成甲醇(CH3OH)的化学反应方程式为CO(g)+2H2(g) CH3OH(g) △H<0 CH3OH(g) △H<0
按照相同的物质的量投料,测的CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是(?? )
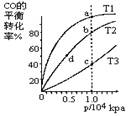
A.平衡常数:K(a)>K(c) K(b)=K(d)
B.正反应速率:v(a)>v(c) v(b)>v(d)
C.平均摩尔质量:M(a)<M(c) M(b)>M(d)
D.平衡时a点一定有n(CO):n(H2)=1:2
参考答案:A
本题解析:
试题分析:该反应的正反应是个气体体积减小的放热反应。化学平衡向吸热方向移动。即化学平衡向逆反应方向移动。这时反应物的转化率降低。由图可看出:T3>T2> T1。所以Ka >Kb> Kc.化学平衡常数只与温度有关,而与压强等无关。所以K(b)=K(d)。A正确。升高温度,不论是正反应速率还是逆反应速率都加快。故正反应速率:v(c) >v (a);在相同温度下,增大压强反应混合物的浓度增大,反应速率加快,由于压强b>d v(b) > v(d)。B错误。C.在相同压强下,温度升高,化学平衡向逆反应方向移动。,由于反应前后质量不变,但气体的物质的量增多故。平均摩尔质量:M(c)<M(a)在相同温度下,增大压强,化学平衡向气体体积减下的方向,即正反应方向移动, M(b)>M(d)。所以C错误。D.反应时CO、H2是按照1:2反应的,所以平衡时a点可能有n(CO):n(H2)=1:2,也可能不是。错误。
本题难度:一般
|