微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列溶液加热蒸干、灼烧后,能析出原溶质固体的是( )
A.AlCl3
B.KHCO3
C.Fe2(SO4)3
D.NH4HCO3
参考答案:C
本题解析:
试题分析:溶液加热蒸干、灼烧后所得固体成分的判断要考虑①水解型②分解型③氧化型。A、加热时促进Al3+水解,盐酸易挥发,生成Al(OH)3,灼烧的氧化铝固体,错误;B、KHCO3不稳定,加热易分解,所得固体成分为K2CO3,错误;C、加热时虽然促进Fe3+水解,但硫酸难挥发,硫酸和氢氧化铁反应生成Fe2(SO4)3,最后固体仍为Fe2(SO4)3,正确;D、NH4HCO3不稳定,加热易分解生成氨气、水和二氧化碳,无固体剩余,错误。
考点:考查盐类水解知识。
本题难度:一般
2、选择题 将AlCl3溶液和NaAlO2溶液分别蒸干并灼烧,所得产物主要成分为
A.都是Al(OH)3
B.前者是Al2O3,后者是NaAlO2
C.都是Al2O3
D.前者是AlCl3,后者是NaAlO2
参考答案:B
本题解析:
本题难度:困难
3、填空题 (1)25℃时,pH=12.0的KOH溶液中,由水电离出的C(OH-)=_______mol/L;pH=12.0的K2CO3溶液中,由水电离出来的C(OH-)=_______mol/L。
(2)常温下0.1mol·L-1 CH3COONa溶液PH=8
①用离子方程式表示CH3COONa溶液PH=8的原因:
②按物质的量浓度由大到小顺序排列该溶液中各种微粒(水分子除外)
(3)FeCl3的水溶液呈 (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示): , 实验室在配制FeCl3的溶液时,常将FeCl 3固体先溶于 中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解,否则得到的是浑浊的溶液。
参考答案:(1)1×10-12 &#
本题解析:
试题分析:(1)抑制水电离,含有弱根离子的盐促进水电离,碱溶液中水电离出的c(OH-)=c(H+)=10-12 mol/L,K2CO3是强碱弱酸盐,促进水电离,溶液中水电离出的c(OH-) 为水的离子积常数与c(H+)的比,所以水电离出来的c(OH-)=10?14/10?12mol/L=10-2 mol/L。(2)①醋酸钠中醋酸根离子能水解,导致溶液显示碱性,即CH3COO-+H2O CH3COOH+OH- ,②按物质的量浓度由大到小顺序排列该溶液中各种微粒为:c(Na+)>c(CH3COO-)>c(H+)>c(OH-);(3)FeCl3的水溶液中,由于三价铁离子的水解,导致溶液呈酸性,Fe3++3H2O
CH3COOH+OH- ,②按物质的量浓度由大到小顺序排列该溶液中各种微粒为:c(Na+)>c(CH3COO-)>c(H+)>c(OH-);(3)FeCl3的水溶液中,由于三价铁离子的水解,导致溶液呈酸性,Fe3++3H2O  Fe(OH)3+3H+ ,将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,这样盐酸可以抑制三价铁离子水解;
Fe(OH)3+3H+ ,将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,这样盐酸可以抑制三价铁离子水解;
考点:离子积常数;溶液pH的定义;铁的化学性质。
本题难度:困难
4、填空题 (12分)镧是重要的稀土元素,应用非常广泛,如应用于压电材料、催化剂等领域。
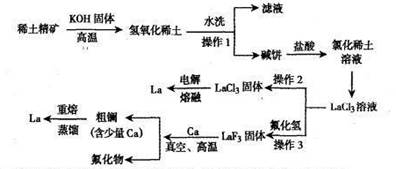
已知:①镧是较活泼金属,在空气中易被氧化;②氢氧化镧是难溶于水的弱碱;
③
金属
| 熔点(℃)
| 沸点(℃)
|
钙
| 841
| 1487
|
镧
| 920
| 3470
(1)操作1、3是相同操作,其名称是 。
(2)操作2中要在HCl气体的氛围内加热的原因是 。
(3)电解制镧的尾气要用碱液吸收,请写出反应的离子方程式 。
(4)真空、高温过程中的反应方程式为 。

(5)粗镧精制过程中温度控制范围 。
(6)重熔蒸馏制得的镧中仍然混有及少量的钙。某批次产品69.709g,经分析含钙0.209g,该产品的等级为 (化工产品等级标准:优级纯≥99.8
参考答案:
本题解析:
本题难度:一般
5、选择题 下列溶液中各微粒的浓度关系不正确的是
A.0.1 mol/L的HCOOH溶液中:c(HCOO—)+c(OH—)=c(H+)
B.1 L 0.1 mol/L的CuSO4·(NH4)2SO4·6H2O的溶液中: c(SO42—)>c(NH4+)>c(Cu2+)>c(H+)>c (OH—)
C.0.1 mol/L 的NaHCO3溶液中: c(Na+)+c(H+)=c(HCO3—)+2c(CO32—)+c(OH—)
D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:
c(Na+)>c(HX)>c(X—)>c(H+)>c(OH—)
参考答案:D
本题解析:
试题分析:A、根据电荷守恒可知,0.1 mol/L的HCOOH溶液中:c(HCOO—)+c(OH—)=c(H+),A正确;B、铜离子和铵根离子均水解,溶液显酸性,所以1 L 0.1 mol/L的CuSO4·(NH4)2SO4·6H2O的溶液中: c(SO42—)>c(NH4+)>c(Cu2+)>c(H+)>c (OH—),B正确;C、根据电荷守恒可知0.1 mol/L 的NaHCO3溶液中: c(Na+)+c(H+)=c(HCO3—)+2c(CO32—)+c(OH—),C正确;D、根据电荷守恒可知,在等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中存在c(Na+)+ c(H+)=c(X—)+c(OH—),所以不可能存在c(Na+)>c(HX)>c(X—)>c(H+)>c(OH—),D错误,答案选D。
考点:考查溶液中离子浓度大小比较
本题难度:困难
|