微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 在溶液中,反应A +2B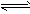 C分别在三种不同实验条件下进行,它们的起始浓度均为c( A)=0.100 mol/L、c(B) =0.200 mol/L及c(C) =0 mol/L。反应物A的浓度随时间的变化如下图所示。
C分别在三种不同实验条件下进行,它们的起始浓度均为c( A)=0.100 mol/L、c(B) =0.200 mol/L及c(C) =0 mol/L。反应物A的浓度随时间的变化如下图所示。
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②_________________________________________________;
③_________________________________________________;
(2)实验②平衡时B的转化率为________ ;实验③平衡时C的浓度为________;
(3)该反应的△H_____ 0,其判断理由是_______
(4)该反应进行到4.0 min时的平均反应速率:
实验②:VB=____________,
实验③:VC=____________。
参考答案:(1)加催化剂,达到平衡的时间缩短,平衡时A的浓度未变;温度
本题解析:
本题难度:一般
2、简答题 氮有多种氧化物,其中N2O5是一种新型硝化剂,其性质和制备收到人们的关注.
(1)一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g)?4NO2(g)+O2(g);△H>0
①反应达到平衡后,若再通入一定量氩气,则N2O5的转化率将______(填“增大”、“减小”、“不变”).
②如表为反应在T1温度下的部分实验数据:
| t/s | 0 | 500 | 1000
c(N2O5)/mol?L-1
5.00
3.52
2.48
则500s内N2O5的分解速率为______.
③一定温度下,在2L恒容密闭容器中加入2molN2O5,达到平衡时,气体的压强为原来的3
2
,(不考虑NO2聚合成N2O4),则N2O5的转化率a1=______,该温度下反应的平衡常数K=______.
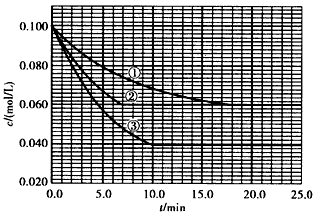
(2)如图1所示装置可用于制备N2O5,则N2O5在电解池的______区生成,其电极反应式为______.
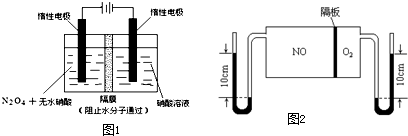
(3)如图2:V(NO):V(O2)=3:1.当抽去NO和O2之间的隔板后,NO和O2反应后成NO2,部分NO2聚合成N2O4(N2O4此时为气态).当体系达到平衡后,U形毛细管两端汞面高度差由反应前10cm变为7.1cm.假设温度不变,且隔板及U形毛细管的体积都忽略不计,此时混合气体的平均相对分子质量为______.
参考答案:(1))①恒温恒容下,通入氮气,反应混合物个组分的浓度不变,
本题解析:
本题难度:简单
3、选择题 在一定温度下,可逆反应A(气)+3B(气)  2C(气)达到平衡的标志是 2C(气)达到平衡的标志是
A.A、B、C的分子数比为1:3:2???????
B.A、B、C的浓度相等
C.C生成的速率与C分解的速率相等???
D.单位时间生成n mol A,同时生成3n mol B
参考答案:C
本题解析:
试题分析:判断一个可逆反应是否达到化学平衡状态,可以从两个方面来考虑:(Ⅰ) v正=v逆>0;(Ⅱ) 混合物各成分浓度不变(注意固体的浓度时常数)。只要符合其一则达到平衡状态。C项中C生成的速率与C分解的速率相等说明v正=v逆,正确。
本题难度:一般
4、选择题 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是
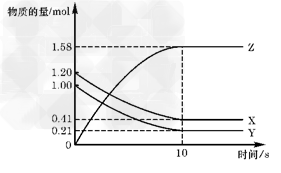 [???? ] [???? ]
A.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)
B.反应开始时10s,X的物质的量浓度减少了0.79mol/L
C.反应开始时10s,Y的转化率为0.79(转化率=参加反应的物质的物质的量÷该物质的起始物质的量)
D.反应的化学方程式为:X(g)+Y(g) Z(g) Z(g)
参考答案:C
本题解析:
本题难度:一般
5、选择题 当把晶体N2O4放入恒容的密闭容器中,待全部气化并建立N2O4 2NO2平衡后,保持温度不变,再放入N2O4晶体并全部气化,待反应达到新的平衡,新平衡与旧平衡比较,其值减小的是?????? ( ) 2NO2平衡后,保持温度不变,再放入N2O4晶体并全部气化,待反应达到新的平衡,新平衡与旧平衡比较,其值减小的是?????? ( )
A.c(NO2)
B.c(N2O4)
C.
D.
参考答案:C
本题解析:根据N2O4 2NO2,反应达到平衡后,再加入N2O4,平衡正向移动,但压强增大不利于N2O4转化为NO2。 2NO2,反应达到平衡后,再加入N2O4,平衡正向移动,但压强增大不利于N2O4转化为NO2。
本题难度:一般
|
|