微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 气体A由C、H、F、S中的三种元素组成,将标准状况下2.80L气体A在过量的O2中完全燃烧后恢复到原状态,放出62.50kJ的热量.已知气体生成物通入过量的Ca(OH)2溶液后无剩余,得到17.38g沉淀.再取相同条件下的2.80L气体A装入一个薄膜袋中,袋和气体的总质量4.50g(已知CaSO3,CaF2,CaCO3难溶于水,HF难电离).
(1)根据上述数据计算,A的相对分子质量不会大于______,由此可知,组成A的三种元素为______,化学式为______.
(2)写出生成17.38g沉淀时,发生反应的离子方程式______.
(3)薄膜袋的质量为______.
(4)写出该条件下A在O2中燃烧的热化学方程式______.
参考答案:(1)气体的总质量的极值为4.50g,准状况下2.80L气体
本题解析:
本题难度:一般
2、选择题 25℃、101kPa时,1g甲醇完全燃烧生成CO2和液态H2O,同时放出22.68kJ热量。下列表示该反应的热化学方程式中正确的是 [???? ]
A.CH4O(l)+3/2O2(g) = CO2(g) +2H2O(l) △H=-725.8kJ/mol
B.2CH4O(l)+3O2(g)= 2CO2(g)+4H2O(l) △H=+1451.6kJ/mol
C.2CH4O+O2 = 2CO2+4H2O(l) △H=-22.68kJ/mol
D.CH4O(l)+3/2O2(g) = CO2(g)+2H2O(g) △H=-725.8kJ/mol
参考答案:A
本题解析:
本题难度:一般
3、填空题 CO、CH4均为常见的可燃性气体。
(1)等体积的CO和CH4在相同条件下分别完全燃烧,转移的电子数之比是_________。
(2)已知在101kPa时,CO的燃烧热为283kJ/mol。相同条件下,若2molCH4燃烧生成液态水,所放出的热量为1molCO完全燃烧放出热量的6.30倍,CH4完全燃烧反应的热化学方程式是
_____________________________。
(3)120℃、101kPa下,amL由CO、CH4组成的混合气体在bmLO2中完全燃烧后,恢复到原温度和压强。
①若混合气体与O2恰好完全反应,产生bmLCO2,则混合气体中CH4的体积分数为
________(保留两位小数)。
②若燃烧后气体体积缩小了a/4mL,则a与b的数学关系表达式是_________。
参考答案:(1)1:4
(2)CH4(g)+2O2(g)
本题解析:
本题难度:一般
4、填空题 铝及其化合物在生产生活中具有重要的作用。
(1)铝在元素周期表中的位置是 。
(2)已知电负性的数值表示原子对电子吸引能力的相对大小。以下是几种原子的电负性数值:
元素
| 钠
| 镁
| 铝
| 硅
|
电负性
| 0.9
| 1.2
| χ
| 1.8
①铝的电负性χ的范围是 。
②电负性的数值与元素金属性的关系是 。
③下列实验能比较镁和铝的金属性强弱的是 。
a.测定镁和铝的导电性强弱
b.测定等物质的量浓度的Al2(SO4)3和MgSO4溶液的pH
c.向0.1 mol/LAlCl3和0.1 mol/L MgCl2中加过量NaOH溶液
(3)铝热法是常用的金属冶炼方法之一。
已知:4Al(s)+3O2(g)=2Al2O3(s) ΔH1=-3352 kJ/mol
Mn(s)+O2(g)=MnO2(s) ΔH2= -521 kJ/mol
Al与MnO2反应冶炼金属Mn的热化学方程式是 。
(4)冶炼金属铝时,用石墨做电极电解熔融Al2O3。液态铝在(填“阴”或“阳”) 极得到,电解过程中,阳极石墨需要不断补充,结合电极反应说明其原因是 。
参考答案:(14分,每空2分)
(1)第3周期第ⅢA族
(
本题解析:
本题难度:困难
5、填空题 (1)常温下有PH分别为8、9、10的三种相同物质的量浓度的盐溶液NaX、NaY、NaZ,比较盐酸、HX、HY、HZ四种酸酸性由强到弱
(2)已知25°C时:
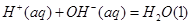 
氢氟酸是一种弱酸,可用来刻蚀玻璃。20ml0.1mol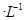 的氢氟酸与0.1mol/L 的氢氟酸与0.1mol/L
氢氧化钠溶液完全反应时放热aJ,写出氢氟酸电离的热化学方程式
参考答案:HCl 、HX、HY、HZ
 本题解析:(1)酸越弱,相应的钠盐越容易水解,碱性越强,所以根据钠盐的pH的相对大小可知,盐酸、HX、HY、HZ四种酸酸性由强到弱HCl 、HX、HY、HZ。 本题解析:(1)酸越弱,相应的钠盐越容易水解,碱性越强,所以根据钠盐的pH的相对大小可知,盐酸、HX、HY、HZ四种酸酸性由强到弱HCl 、HX、HY、HZ。
(2)反应中生成水是0.002mol,所以生成1mol水放出的热量0.5akJ。则根据盖斯定律可知,1mol氢氟酸电离吸热是(57.3-0.5a)kJ,因此热化学方程式为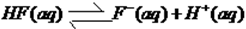 △H==+(57.3-0.5a)kJ/mol △H==+(57.3-0.5a)kJ/mol
本题难度:一般
|