微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)
(1)已知C(石墨,s)= C(金刚石,s);△H>0,则稳定性:金刚石 石墨(填>或<)
(2)已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2。则△H1 △H2(填>或<)
(3)“嫦娥五号”预计在海南文昌发射中心发射,火箭的第一、二级发动机中,所用的燃料为偏二甲肼和四氧化二氮,偏二甲肼可用肼来制备. 用肼(N2H4)为燃料,四氧化二氮做氧化剂,两者反应生成氮气和气态水.
已知:N2(g)+2O2(g)=N2O4(g) △H="+10.7kJ·" mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H="-543" kJ· mol-1
写出气态肼和N2O4反应的热化学方程式为 。
(4)25℃,101kPa时,14gCO在足量的O2中充分燃烧,放出141.3 kJ的热,则CO的燃烧热为△H= 。
(5)0.50L 2.00mol/L H2SO4溶液与2.10L 1.00mol/L KOH溶液完全反应,放出114.6kJ的热量,该反应的中和热为△H=
(6)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391 kJ、
946 kJ,则N2与H2反应生成NH3的热化学方程式是 。
参考答案:(12分,每空2分) (1)<
本题解析:
试题分析:(1)已知C(石墨,s)= C(金刚石,s);△H>0,这说明该反应是吸热反应,因此石墨的总能量低于金刚石。能量越低越稳定,则稳定性金刚石 <石墨。
(2)碳完全燃烧放热多,但放热越多△H越小。因此如果2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1<△H2 。
(3)已知:①N2(g)+2O2(g)=N2O4(g) △H="+10.7kJ·" mol-1,②N2H4(g)+O2(g)=N2(g)+2H20(g) △H="-543" kJ· mol-1,则根据盖斯定律可知②×2—①即顶点气态肼和N2O4反应的热化学方程式为2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=—1096.7kJ· mol-1。
(4)25℃,101kPa时,14gCO在足量的O2中充分燃烧,放出141.3 kJ的热,则1molCO即28gCO完全燃烧放出的热量是282.6kJ。由于燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,则CO的燃烧热为△H=-282.6kJ· mol-1。
(5)0.50L 2.00mol/L H2SO4溶液与2.10L 1.00mol/L KOH溶液完全反应,放出114.6kJ的热量,反应中生成2mol水。又因为中和热是在一定条件下,稀溶液中,强酸和强碱反应生成1mol水时所放出的热量,所以该反应的中和热为△H=-57.3kJ· mol-1 。
(6)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391 kJ、946 kJ,又因为反应热等于断键吸收的热量与形成化学键所放出的热量的差值,则N2与H2反应生成2molNH3的燃烧热是436kJ/mol×3+946kJ/mol-391kJ/mol×3×2=—92kJ/mol、则该反应的热化学方程式是N2(g)+3H2(g)=2NH3(g)△H=-92kJ· mol-1。
考点:考查反应热的有关计算与应用、盖斯定律、燃烧热、中和热等
本题难度:一般
2、填空题 SO2和NOx在化学工业上有重要用途,也是大气污染的主要来源,开发和利用并重,预防和治理并举是当前工业上和环境保护领域研究的主要课题之一。
(1)在接触法制硫酸的过程中,发生2SO2(g)+O2(g)  2SO3(g) △H<0反应,某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示,根据图示回答下列问题:
2SO3(g) △H<0反应,某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示,根据图示回答下列问题:
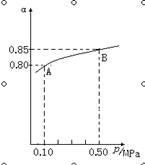
①平衡状态由A到B时,平衡常数K(A) K(B)(填“>”、“<”或“=”);
②将2.0molSO2和1.0molO2置于10L的密闭容器中,若40s后反应达到平衡,此时体系总压强为0.10MPa,这一段时间内SO2的平均反应速率为 。
该反应的平衡常数为 。
(2)用CH4催化还原NOx可消除氮的氧化物的污染,例如:CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol—1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol—1
取标准状况下4.48LCH4并使之完全反应:
①若将NO2还原至N2,整个过程中转移电子的物质的量为 ;
②若还原NO2和NO的混合物,放出的总热量Q的取值范围是 。
参考答案:(1)①=;(1分)②0.0040mol·L-1·s-1,8
本题解析:
试题分析:(1)平衡常数只受温度的影响,温度不变,则压强不变,平衡状态由A变到B时,则k(A)=k(B);(2)由图象知,体系总压强为0.10MPa时SO2的平衡转化率为0.8,则
2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
起始:2.0mol 1.0mol 0
转化:1.6mol 0.8mol 1.6mol
平衡:0.4mol 0.2mol 1.6mol
则平衡时:c(SO2)=0.04mol/L,c(O2)=0.02mol/L,c(SO3)=0.16mol/L,SO2的平均反应速率为1.6mol/10L/40s=0.0040mol·L-1·s-1,K=c(SO3)2/c(SO2)2·c(O2)=(0.16)2/(0.04)2×0.02=800;(2)①CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H="-1160kJ/mol" 利用盖斯定律将①+②/2可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=-867kJ/moln(CH4)=4.48L/22.4L/mol=0.2mol,整个过程中转移的电子总数为:0.20mol×8=1.60mol,放出的热量为:0.2mol×867kJ/mol=173.4kJ。②上述可知,若反应物中全部是为二氧化氮,放出的热量为173.4kJ。根据盖斯定律可据算出若全部为一氧化氮放出热量为232kJ,故放出的热量范围是173.4kJ<Q<232kJ。
考点:盖斯定律,化学平衡常数,化学平衡。
本题难度:困难
3、选择题 根据以下三个热化学方程式:
(1)2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ΔH= -Q1kJ·mol-1
(2)2H2S(g)+O2(g)=2S(g)+2H2O(g) ΔH= -Q2kJ·mol-1
(3)2H2S(g)+O2(g)=2S(g)+2H2O(l) ΔH= -Q3kJ·mol-1
判断 三者关系正确的是
三者关系正确的是
A.Q1>Q2>Q3
B.Q1>Q3>Q2
C.Q3>Q2>Q1
D.Q2>Q1>Q3
参考答案:B
本题解析:
试题分析:硫化氢燃烧得到二氧化硫和水比燃烧得到硫单质和水时氧化程度高释放的热量多。所以Q1>Q2;Q1>Q3,气态水比液态水含有的能量高,所以放热(3) >(2).即Q3>Q2。所以三者关系是:Q1>Q3>Q2。选项为:B。
考点:考查反应热与氧化程度、物质的状态等关系的知识。
本题难度:一般
4、填空题 SNCR-SCR是一种新型的烟气脱硝技术(除去烟气中的NOx),其流程如下:
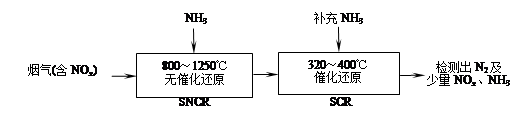
(1)反应2NO+2CO 2CO2+N2能够自发进行,则该反应的ΔH 0(填“>”或“<”)。
2CO2+N2能够自发进行,则该反应的ΔH 0(填“>”或“<”)。
(2)SNCR-SCR流程中发生的主要反应有:
①4NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g) ΔH=-1627.2kJ?mol-1;
4N2(g)+6H2O(g) ΔH=-1627.2kJ?mol-1;
②6NO(g)+4NH3(g) 5N2(g)+6H2O(g) ΔH=-1807.0 kJ?mol-1;
5N2(g)+6H2O(g) ΔH=-1807.0 kJ?mol-1;
③6NO2(g)+8NH3(g) 7N2(g)+12H2O(g) ΔH=-2659.9 kJ?mol-1;
7N2(g)+12H2O(g) ΔH=-2659.9 kJ?mol-1;
反应N2(g)+O2(g) 2NO(g)的ΔH= kJ?mol-1。
2NO(g)的ΔH= kJ?mol-1。
(3)NO2、O2和熔融NaNO3可制作燃料电池,其原理见图。
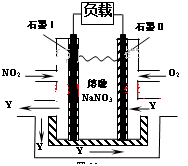
该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应为:
(4)可利用该电池处理工业废水中含有的Cr2O72-,处理过程中用Fe作两极电解含Cr2O72-的酸性废水,随着电解的进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀来除去Cr2O72-。
①写出电解过程中Cr2O72-被还原为Cr3+的离子方程式: 。
②该电池工作时每处理100L Cr2O72-浓度为0.002mol/L废水,消耗标准状况下氧气 L。
参考答案:(1)< (2分)(2)+179.8 (2分) (3)
本题解析:
试题分析:(1)要想反应2NO+2CO 2CO2+N2能够自发进行,则有ΔH—TΔS<0,该反应为气体物质的量减小的熵减反应,ΔS<0,则该反应的ΔH<0;(2)根据盖斯定律:①—②得
2CO2+N2能够自发进行,则有ΔH—TΔS<0,该反应为气体物质的量减小的熵减反应,ΔS<0,则该反应的ΔH<0;(2)根据盖斯定律:①—②得
N2(g)+O2(g) 2NO(g)的ΔH=+179.8kJ?mol-1;(3)由题给燃料电池装置图知,NO2在负极发生氧化反应,生成N2O5,电极反应式为:NO2+NO3--e-=N2O5;(4)①用Fe作两极电解含Cr2O72-的酸性废水,阳极电极反应式为:Fe - 2e-=Fe2+,电解过程中Cr2O72-被还原为Cr3+的离子方程式为
2NO(g)的ΔH=+179.8kJ?mol-1;(3)由题给燃料电池装置图知,NO2在负极发生氧化反应,生成N2O5,电极反应式为:NO2+NO3--e-=N2O5;(4)①用Fe作两极电解含Cr2O72-的酸性废水,阳极电极反应式为:Fe - 2e-=Fe2+,电解过程中Cr2O72-被还原为Cr3+的离子方程式为
Cr2O72-+ 6Fe2++ 14H+= 2Cr3++ 6Fe3++7 H2O;②根据题给反应和电子守恒得Cr2O72-和氧气的关系式:Cr2O72-——3O2;100L Cr2O72-浓度为0.002mol/L废水中Cr2O72-的物质的量为0.2mol,消耗氧气为0.6mol,标准状况下的体积为13.44L。
考点:以化学工艺为载体考查化学反应方向的判断、盖斯定律、电化学及相关计算。
本题难度:困难
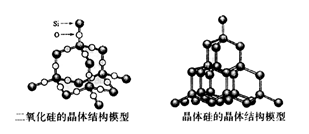
5、选择题 化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差,参考下表键能数据和晶体硅与二氧化硅结构模型估算晶体硅在氧气中燃烧生成二氧化硅晶体的热化学方程式:Si(s)+O2(g)=SiO2(s)中,ΔH的值为
化学键
| Si—O
| O==O
| Si—Si
| Si—Cl
| Si—C
|
键能kJ·mol-1
| 460
| 498.8
| 176
| 360
| 347
A.- 989.2 kJ·mol-1 B.+ 989.2 kJ·mol-1 C.-61.2 kJ·mol-1 D.-245.2 kJ·mol-1
参考答案:A
本题解析:
试题分析:根据二氧化硅晶体结构图和晶体硅晶体结构图可以看出1mol SiO2晶体中含有4molSi—O键,1mol晶体硅中含有2molSi—Si键,所以ΔH="2×176" kJ·mol-1+498.8 kJ·mol-1-4×460 kJ·mol-1="-989.2" kJ·mol-1。答案选A。
考点:反应热
点评:本题的关键是要通过晶体结构分析出1mol晶体中拥有多少摩尔的化学键,锻炼学生的分析问题的能力。
本题难度:一般
|