微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某些食品包装盒中有一个小袋,袋上注明“双吸剂,不可食用”,通过上网查询得知其主要成分是铁粉、活性炭和氯化钠”。关于这种双吸剂的分析判断错误的是
A.具有抗氧化作用
B.可吸收食品盒内的O2和N2
C.发挥作用时利用了原电池原理
D.变为红褐色后失效
参考答案:B
本题解析:
试题分析:是指在空气中即能吸收氧气也能吸收水分的物质,可用铁吸收空气中的氧气与水蒸气,具有抗氧化作用,故A正确;双吸剂能够吸收空气中的O2和水蒸气,但无法吸收空气中的N2,故B错误;双吸剂发挥作用时利用了原电池反应,正极(C):2H2O+O2+4e-=4OH- 负极(Fe):Fe-2e-=Fe2+,故C正确;当铁被氧化为红褐色Fe(OH)3不能在继续与空气中氧气反应,即失效,故D正确。
本题难度:一般
2、选择题 关于右图所示的原电池,下列说法正确的是
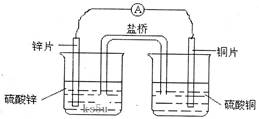
A.电子从锌电极通过检流计流向铜电极
B.盐桥中的阴离子向硫酸铜溶液中迁移
C.锌电极发生还原反应,铜电极发生氧化反应
D.铜电极上发生的电极反应是2H++e-→H2↑
参考答案:
A
本题解析:
本题考查原电池的原理。锌做负极,铜片做正极,电子从负极流向正极,A选项正确;阴离子向负极移动,B选项错误;负极发生氧化反应,正极发生还原反应,C选项错误;铜电极发生的反应为Cu2++2e-=Cu,D选项错误。
本题难度:一般
3、选择题 在盛有稀H2SO4的烧杯中放入用导线连接锌片和铜片,下列叙述正确的是( )
A.正极发生得电子的氧化反应
B.电子通过导线由铜片流向锌片
C.正极有O2逸出
D.铜片上有H2逸出
参考答案:Zn、Cu、硫酸构成的原电池金属锌做负极,金属铜做正极.
本题解析:
本题难度:一般
4、选择题 下列说法正确的是
A.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: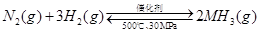 △H=-38.6kJ·mol-1
△H=-38.6kJ·mol-1
B.10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:c(Cl-)>c(CH3COOH) >c(Na+)>c(H+)>c(OH-)
C.实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916 kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以证明在苯分子中不存在独立的碳碳双键
D.在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl—)。用含a的代数式表示NH3·H2O的电离常数Kb=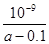
参考答案:C
本题解析:A不正确,因为是可逆反应,无法确定转化率,所以不能计算反应热。B不正确,因为醋酸要电离,所以醋酸的浓度不可能大于钠离子的浓度。环己烯(l)与环己烷(l)相比,形成一个双键,能量降低169kJ/mol,苯(l)与环己烷(l)相比,能量降低691kJ/mol,远大于169×3,说明苯环有特殊稳定结构,所以C正确。D中根据电荷守恒可知,溶液显中性,所以OH-的浓度是10-7mol/L,而溶液中c(NH4+)=0.005mol/L,剩余氨水的浓度是 本题难度:一般
本题难度:一般
5、选择题 按下图装置进行实验,下列描述正确的是(N装置中两个电极均为石墨棒)
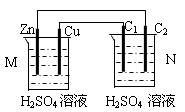
A.C1上发生还原反应
B.M 装置中SO42-移向Cu电极
C.工作一段时间后装置M 中溶液pH变大,装置N中溶液pH变小
D.Cu电极与C2电极上的电极反应相同
参考答案:CD
本题解析:
试题分析:M装置中Zn、Cu电极的活泼性不同,与硫酸溶液形成原电池,Zn是负极,Cu是正极,N装置为电解池,C1与正极相连,则C1是阳极,阳极上发生氧化反应,故A错误;原电池内电路中,硫酸根是阴离子,阴离子移向负极,则硫酸根离子移向Zn电极,氢离子是阳离子,阳离子移向正极,故B错误;负极反应式为Zn—2e-=Zn2+,正极反应式为2H++2e-=H2↑,电池总反应为Zn+2H+=Zn2++H2↑,氢离子浓度逐渐减小,因此工作一段时间后M装置中溶液pH增大,N中用惰性电极电解硫酸溶液,实质就是电解水
本题难度:简单