微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。某课外兴趣小组设计了如图所示流程来探究硫酸厂尾气的成分。请回答:
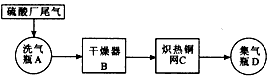
(1)C中炽热铜网可以检验和除去的气体是______________。
(2)①A装置可用于测定硫酸尾气中SO2的含量,其中应盛装试剂可能是___________。
A.NaOH溶液、酚酞试液
B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液
D.氨水、酚酞试液
②SO2是引发酸雨的主要气体之一,因此尾气吸收须经过处理才能排人到大气之中。一般方法是将尾气循环使用后通入氨水中进行吸收。试写出其中可能发生的两个氧化还原反应的化学方程式: ______________,________________。
(3)B中装有碱性干燥剂,D中收集到一种较为纯净的气体。试设计一实验验证其为氮气。
参考答案:(1)O2
(2)①BC;②2H2SO3+O2 =
本题解析:
本题难度:一般
2、实验题 下面是某科学兴趣小组的同学做同周期元素性质递变规律实验时,设计的一套实验方案。其中实验步骤如下

请整理并完成实验报告。
(1)实验目的:________。
(2)实验用品:试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlCl3溶液,NaOH溶液等。仪器:①____,②______,表面皿,试管夹,镊子,小刀,玻璃片,砂纸等。
(3)实验内容:(完成下列表格中的实验现象和化学方程式,实验步骤略)
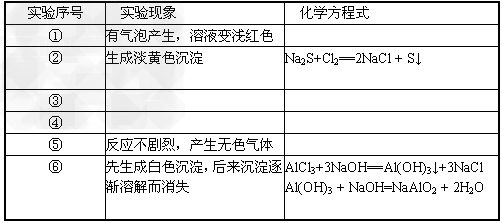
(4)实验结论:________。
(5)请用原子结构的知识简单解释上述结论:_______________。
参考答案:(1)探究同周期元素性质的递变规律?
(2)试管;酒精
本题解析:
本题难度:一般
3、简答题 硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、A12O3、CaO、MgO等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如图:
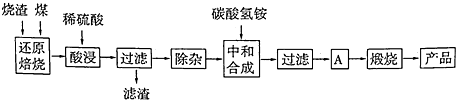
(1)在“还原焙烧”中产生的有毒气体可能有______.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是______(用离子方程式表示).
(3)根据下表数据:
| 氢氧化物 | Al(OH)3 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2
开始沉淀的pH
3.10
8.54
2.01
7.11
完全沉淀的pH
4.77
11.04
3.68
9.61
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于______,检验Fe3+已经除尽的试剂是______;当pH=5时,溶液中c(Al3+)=______mol?L-1(已知常温下Ksp[Al(OH)3]=2.0×10-33).
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则A的操作是______.
(5)ag烧渣经过上述工艺可得红氧化铁bg.药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于______(用含a、b的表达式表示).
参考答案:(1)硫铁矿烧渣是一种工业废渣(含Fe2O3及少量SiO2、
本题解析:
本题难度:一般
4、实验题 工业上将纯净干燥的氯气通入到0.375 mol/L NaOH溶液中得到漂白水。某同学想在实验室探究Cl2的性质并模拟制备漂白水,下图是部分实验装置。已知KMnO4与盐酸反应可以制取Cl2。
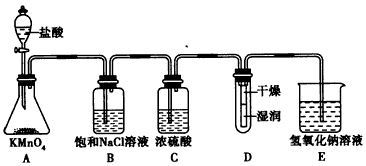
(1)配制物质的量浓度为0.375 mol/L NaOH溶液时,用托盘天平称取所需的NaOH质量为__________。
(2)浓硫酸的作用是______________________。
(3)装置E中发生化学反应方程式为______________________________。
(4)装置B中饱和NaCl溶液的作用是_______________。
(5)实验时装置D中湿润的部分红色纸条褪色,干燥部分没有褪色,放置一段时间后,纸条全部褪色。该同学认为Cl2的密度比空气大,可能是试管下部Cl2的浓度大于试管上部Cl2的浓度所导致的。请判断该解释是否合理,并分析产生上述实验现象的原因;如需改进,请简述设计方案(若认为合理,则此问可不作答)___________________。
(6)氯元素含量为10%的漂白水溶液355 g,其中含NaClO的物质的量为___________mol。
参考答案:(1)1.5 g
(2)干燥氯气
(3)Cl2
本题解析:
本题难度:一般
5、实验题 全世界每年被腐蚀损耗的钢铁量非常惊人,在潮湿空气中发生吸氧腐蚀是钢铁腐蚀的主要原因。
(1)在潮湿空气中,钢铁发生吸氧腐蚀时的负极反应的电极反应式为_____________。
(2)已知草酸(H2C2O4)分解的化学方程式为:H2C2O4  CO↑ + CO2↑ + H2O, CO↑ + CO2↑ + H2O,
下列装置中,可用作草酸分解制取气体的是______(填答案编号)。

(3)某实验小组为测定铁锈样品的组成(假定铁锈中只有Fe2O3·nH2O和Fe两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如下图所示。

①为得到干燥、纯净的CO气体,洗气瓶A、B中盛放的液态试剂依次可能是_______、
________(填答案编号)。
a.浓硫酸????b.澄清的石灰水???? c.氢氧化钠溶液???d.无水氯化钙
②在点燃C处酒精灯之前应进行的操作是:(a)检查装置气密性;(b)____________。
③E装置的作用是______________________________________________________,
上述装置最后尾气处理的方法是_____________。
④准确称量样品的质量10.00g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为8.32 g,D中浓硫酸增重0.72 g,则n =_____________。
⑤在本实验中,下列情况会使测定结果n偏大的是__________(填答案编号)。
a.缺少装置B? b.缺少装置E ? c.反应后的固体中有少量Fe2O3·nH2O
参考答案:1) Fe—2e-- = Fe2+?(2分)
(2)(
本题解析:略
本题难度:一般
|