微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)工业制硫酸时,利用接触氧化反应将SO2转化为SO3是一个关键的步骤。
(1)在接触室中2SO2(g)+O2(g)  2SO3(g)达到平衡状态的标志是______。
2SO3(g)达到平衡状态的标志是______。
A.υ(O2)正=2υ(SO2)逆
B.容器中气体的总质量不随时间而变化
C.容器中气体的颜色不随时间而变化
D.容器中气体的压强不随时间而变化
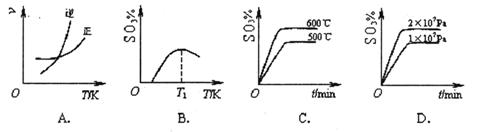
(2)下列关于反应2SO2(g)+O2(g)  2SO3(g) ΔH<0。下列图像中不正确的是______ (填字母序号)。
2SO3(g) ΔH<0。下列图像中不正确的是______ (填字母序号)。
(3)某温度下SO2(g)+  O2(g)
O2(g)  SO3(g) ΔH=-98KJ/mol
SO3(g) ΔH=-98KJ/mol
①开始时在体积固定的密闭容器中加入4mol SO2 (g)和1mol O2 (g),达到平衡时 共放出196 KJ的热量,该温度下SO2的平衡转化率为______
②已知固态单质硫的燃烧热为296KJ/mol,则由S(s)生成2 molSO3(g)的ΔH为____________
(4)检验SO42-常用BaCl2溶液。常温时,BaSO4的Ksp=1.08×10-10,现将等体积的BaCl2溶液与2.0×10-3mol/L的H2SO4溶液混合。若要生成BaSO4沉淀,原BaCl2溶液的最小浓度为____________
参考答案:(12分)
(1)D?(2分)
(2)C?(2分
本题解析:
试题分析:
(1)平衡状态的为正反应速率等于你反应速率,各组分的量保持不变即达到平衡状态,A、正逆反应速率不相等,不能说明;根据质量守恒,整个反应过程中质量、颜色均不变化,不能说明,BC错误;D、反应过程中压强减小,压强不变说明达到平衡状态,正确。
(2)A、温度升高,正逆反应速率同时增大,平衡逆向移动,正确;B、温度升高平衡逆向移动,正确;C、温度升高速率加快,平衡逆向移动,正确;D压强越大,速率越快,增大压强,平衡正向移动,SO3%减小。
(3)①根据比例,放出196KJ的能量,反应SO22mol,故转化率为50%;
②根据盖斯定律计算可以得到,该反应的反应热为-788KJ/mol;
(4)离子浓度计算按混合后的进行计算,c(Ba2+)=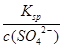 =
=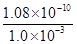 =1.08×10-7mol/L,混合前的弄得为2.16×10-7mol/L。
=1.08×10-7mol/L,混合前的弄得为2.16×10-7mol/L。
本题难度:一般
2、选择题 在一定温度下,体积不变的密闭容器中可逆反应A(g)+3B(g)  2C(g) 达到平衡的标志是
2C(g) 达到平衡的标志是
A.气体的密度不再变化
B.A、B、C的浓度之比为1:3:2
C.A、B、C的浓度不再变化
D.单位时间内生成n molA,同时生成3n molB
参考答案:C
本题解析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以选项C正确;密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此选项A不正确;平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,所以选项B不正确;选项D中反应速率的方向是相同的,速率之比是相应的化学计量数之比,因此D中的关系始终是成立,不正确,所以正确的答案选A。
本题难度:一般
3、填空题 将1molI2(g)和2molH2置于某2L密闭容器中,在一定温度下发生反应:
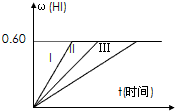
I2(g)+H2(g) 2HI(g);△H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线(II)所示:(提示:同条件体积分数=物质的量分数)
2HI(g);△H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线(II)所示:(提示:同条件体积分数=物质的量分数)
(1)达平衡时,I2(g)的物质的量浓度为________________。
(2)若改变反应条件下,在甲条件下ω(HI)的变化如图曲线(I)所示,在乙条件下ω(HI)的变化如图曲线(III)所示。则甲条件可能是________________(填入下列条件的序号。下同),乙条件可能是
________________。
① 恒容条件下,升高温度;② 恒容条件下,降低温度;③ 恒温条件下,缩小反应容器体积;
④ 恒温条件下,扩大反应容器体积;⑤ 恒温恒容条件下,加入适当催化剂。
(3)若保持温度不变,在另一相同的2L密闭容器中加入amol I2(g)、bmol H2和cmol HI(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c的关系是:________________。
参考答案:(1)0.05mol·L-1
(2)③⑤;④
本题解析:
本题难度:一般
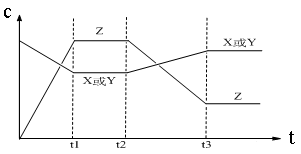
4、选择题 今有X(g)+Y(g)  2Z(g) △H<0。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,引起t2→t3曲线变化的原因是
2Z(g) △H<0。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,引起t2→t3曲线变化的原因是
A.增大X或Y的浓度
B.增大压强
C.增大Z的浓度
D.升高温度
参考答案:D
本题解析:
试题分析:根据图像可知,t2时反应物的浓度逐渐增大,而生成物的浓度逐渐减小,因此改变的条件一定不是浓度或压强。由于平衡向逆反应方向移动,而正方应是体积不变的、放热的可逆反应,因此改变的条件只能是升高温度,升高温度平衡向吸热的方向移动,答案选D。
本题难度:一般
5、填空题 (10分)一定的温度下向2L密闭容器中通入2molSO2和2molO2,发生反
应: 2SO2+O2 2SO3.5min后达到平衡,测得容器中有SO31.6mol.
2SO3.5min后达到平衡,测得容器中有SO31.6mol.
回答下列问题:
(1)?反应5min内,v(O2)=_________mol.L-1.min-1.
(2)?化学反应达到平衡时,SO2消耗的浓度占起始浓度的百分比为__________;此时,容器中c(O2)=_______,压强是起始时的_______倍.
(3)?判断该反应达到平衡的标志是_______________;
A.v消耗(SO2)=v生成(SO3)
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.容器中气体的总物质的量不再变化
参考答案:(1)0.08?(2)80%;0.6 mol.L-1; 0.
本题解析:(1)考查可逆反应的有关计算。
2SO2??+? O2 2SO3
2SO3
起始量(mol)???????????????????? 2???????? 2????? 0
转化量(mol)??????????????????? 1.6?????? 0.8??? 1.6
平衡量(mol)??????????????????? 0.4?????? 1.2??? 1.6
所以氧气的反应速率是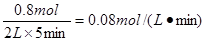
(2)SO2消耗的浓度占起始浓度的百分比为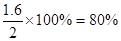
此时氧气的浓度
(3)A中反应速率方向相同,所以不能证明。混合气的密度是混合气的质量和容器容积的比值,质量和容积均不变,所以密度始终是不变的。混合气体的平均相对分子质量是混合气的质量和混合气的物质的量的比值,质量不变,但混合气的物质的量是变化的,所以BD正确,即答案是BD。
本题难度:一般