α2
下列说法不正确的是????????????????????????????????????????(??????)
A. cl 一定等于c2 ???????????????? B.a + b = 92.4
C. p1 一定等于p2 ???????????????? D.α1 一定等于α2
参考答案:D
本题解析:因为恒温恒容,体积可变的反应,容器1和2中是从不同方向进行的等效平衡,ABC正确,因为进行的方向不同α1 不等于α2
本题难度:一般
2、选择题 为了探究外界条件对反应aX(g)+bY(g)  cZ(g)的影响,以X和Y物质的量之比为a∶ cZ(g)的影响,以X和Y物质的量之比为a∶
b开始反应,通过实验得到不同条件下达到平衡时Z的体积分数,实验结果如下图所示。以下判断正确的是(??)
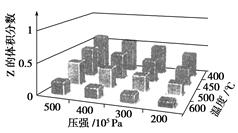
A.ΔH>0,a+b>c
B.ΔH>0,a+b<c
C.ΔH<0,a+b>c
D.ΔH<0,a+b<c
参考答案:C
本题解析:由图可知,随压强的增大,Z的体积分数增大,说明平衡正向移动,正反应是气体分子数减小的反应。随温度的升高,Z的体积分数减小,说明平衡向逆反应方向移动,逆反应是吸热反应,则正反应是放热反应。
本题难度:一般
3、选择题 其他条件不变的情况下,下列说法不正确的是(????)
A.对于反应nA(g)+B(g) 2C(g),平衡后增大压强,A的百分含量减小,则n≥2。 2C(g),平衡后增大压强,A的百分含量减小,则n≥2。
B.对于反应2A(g) B(g)△H<0,恒温恒容,压强不再变化说明反应达到平衡状态。 B(g)△H<0,恒温恒容,压强不再变化说明反应达到平衡状态。
C.对于反应2A(g) B(g),恒温恒容条件下,气体密度不变,说明达到平衡状态 B(g),恒温恒容条件下,气体密度不变,说明达到平衡状态
D.对于反应2A(g) B(g),若v(A)正=2v(B)逆,说明反应达到平衡状态 B(g),若v(A)正=2v(B)逆,说明反应达到平衡状态
参考答案:C
本题解析:
试题分析:A.平衡后增大压强,A的百分含量减小,说明增大压强,平衡正向移动。根据平衡移动原理:增大压强,化学平衡向气体体积减小的方向移动。正反应方向是气体体积减小的反应方向。所以n+1>2.n>1.由于为正整数。所以n≥2。正确。B.由于该反应是反应前后气体体积不等的放热反应。所以根据平衡移动原理,若在恒温恒容条件下,压强不再变化,则说明反应达到平衡状态。正确。C.在恒温恒容条件下,无论反应是否发生,也无论反应是否达到平衡,气体密度都不变,因此不能说明反应是否达到平衡状态。错误。D.在任何时刻都存在v(A)正=2v(B)正;若v(A)正=2v(B)逆则v(B)正=v(B)逆。对于同种物质来说,正反应与逆反应速率相等。则反应达到了平衡状态。正确。
本题难度:一般
4、填空题 在100℃时,将0.200 mol的四氧化二氮气体充入2L抽空的密闭容器中,每隔一定时间对该容器内物质的浓度(mol/L)进行分析,得到如下表格:
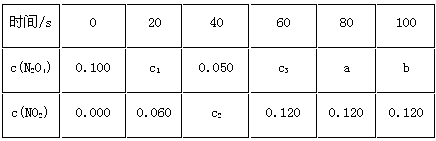
试填空:
(1)该反应的化学方程式为_____________,达到平衡时四氧化二氮的转化率为______%。
(2)20s时四氧化二氮的浓度c1=________mol·L-1,在0~20s时间段内,四氧化二氮的平均反应速率为________mol·L-1·s-1。
(3)若在相同情况下最初向容器中充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的初始浓度为________mol·L-1。
参考答案:(1)N2O4![]() 本题解析: 本题解析:
本题难度:一般
5、选择题 一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g),甲醇生成量与时间的关系如下图所示。 CH3OH(g),甲醇生成量与时间的关系如下图所示。
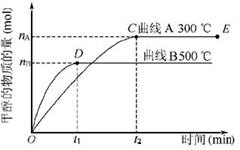
下列有关说法正确的是( )
A.在300 ℃条件下,t1时刻该反应达到化学平衡
B.在500 ℃条件下,从反应开始到平衡,氢气的平均反应速率v(H2)为nB/(3t1) mol/L
C.在其他条件不变的情况下,将处于E点的体系体积压缩到原来的1/2,则氢气的浓度减小
D.由图像说明该反应的正反应为放热反应
参考答案:D
本题解析:A 错误,在500 ℃条件下,t1时刻该反应达到化学平衡
B 错误,氢气的平均反应速率v(H2)为2nB/(3t1) mol/L
C 错误,体积减小,浓度增大
D 正确,升高温度,甲醇的物质的量减小,平衡左移,故逆反应是吸热反应,正反应为放热反应。
本题难度:一般
|