微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 (22分)研究碳及其化合物的性质和用途是中学化学的任务之一。
I.某兴趣小组在实验室中制备碳酸钠溶液。方案如下:步骤一,取25 mL一定浓度的NaOH溶液,通人CO2气体至过量;步骤二,加热煮沸步骤一所得溶液;步骤三,另取25 mL相同浓度的NaOH溶液与步骤二所得溶液混合,即得碳酸钠溶液。
(1)完成步骤一可选的化学试剂有:稀盐酸、NaOH溶液、大理石、饱和碳酸钠溶液、稀硫酸、饱和碳酸氢钠溶液等,需要的装置如下所示。

①各装置正确的连接顺序为 (用a、b、c、d表示)。
②检查整套装置气密性的方法是 。
③装置A中常用药品为 ;装置C中化学药品的作用是 。
(2)写出步骤三中发生反应的离子方程式 。
(3)有同学提出“步骤二”没有必要,请你简述自己的看法 。
Ⅱ.实验室用纯碱和盐酸处理某种蛇纹石(已知蛇纹石中含有MgO、SiO2.CaO、Fe2O3、Al2O3等氧化物)模拟制备氧化镁的流程如下:
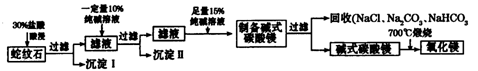
(1)过滤需要的玻璃仪器有 。
(2)沉淀Ⅱ的成分为 ,请用离子方程式表示生成沉淀的过程 (写出一个即可)。
(3)纯碱溶液中所有离子浓度的大小关系为 。
(4)已知l0%的纯碱溶液密度为1.06g/cm3,则其物质的量浓度为____ ,
参考答案:I.(1)①a 本题解析:
本题解析:
试题分析:I.根据题意知,该小组制备碳酸钠溶液的原理为:CO2(过量)+NaOH====NaHCO3,NaOH+NaHCO3====Na2CO3+H2O。(1)分析题给装置知,A为二氧化碳的发生装置,B中发生二氧化碳与氢氧化钠溶液的反应,C装置除去二氧化碳中的氯化氢;①为制得纯净的碳酸氢钠溶液,要先除去二氧化碳中的氯化氢,各装置正确的连接顺序为a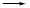 d
d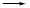 c
c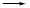 b。②检查整套装置气密性的方法是关闭分液漏斗活塞,向烧杯中加水至没过导管口,微热烧瓶,导管口有气泡冒出,停止加热,导管内形成一段水柱,说明装置气密性良好。③实验室制备二氧化碳的原理为碳酸钙和稀盐酸反应,装置A中常用药品为稀盐酸和大理石;装置C中化学药品的作用是除去二氧化碳中的氯化氢。 (2)步骤三中发生反应的离子方程式为OH-+HCO3—====CO32—+H2O。 (3)步骤二的目的为除去溶解的过量的二氧化碳,否则将使碳酸钠不纯。
b。②检查整套装置气密性的方法是关闭分液漏斗活塞,向烧杯中加水至没过导管口,微热烧瓶,导管口有气泡冒出,停止加热,导管内形成一段水柱,说明装置气密性良好。③实验室制备二氧化碳的原理为碳酸钙和稀盐酸反应,装置A中常用药品为稀盐酸和大理石;装置C中化学药品的作用是除去二氧化碳中的氯化氢。 (2)步骤三中发生反应的离子方程式为OH-+HCO3—====CO32—+H2O。 (3)步骤二的目的为除去溶解的过量的二氧化碳,否则将使碳酸钠不纯。
Ⅱ.根据题给流程分析,蛇纹石用30%盐酸酸浸,MgO、CaO、Fe2O3、Al2O3和盐酸反应溶解,反应方程式分别为:MgO+2HCl=MgCl2+H2O,CaO+2HCl=CaCl2+H2O,Fe2O3+6HCl=2FeCl3+3H2O,Al2O3+6HCl=2AlCl3+3H2O;而SiO2不与盐酸反应,过滤得沉淀Ⅰ为二氧化硅,滤液为MgCl2、CaCl2、FeCl3、AlCl3和盐酸的混合液,向滤液中加入一定量10%纯碱溶液,Ca2+、Fe3+、Al3+和碳酸钠溶液反应转化为氢氧化铁、氢氧化铝和碳酸钙沉淀经过滤而除去,反应方程式为CO32- + Ca2+====CaCO3↓,2Fe3+ + 3CO32- + 3H2O ="===" 2Fe(OH)3↓ + 3CO2↑,2Al3+ + 3CO32- + 3H2O====2Al(OH)3↓ + 3CO2↑;向滤液中加足量15%纯碱溶液制得碱式碳酸镁,过滤,回收氯化钠、碳酸钠和碳酸氢钠,碱式碳酸镁煅烧得氧化镁。(1)过滤需要的玻璃仪器有烧杯、漏斗、玻璃棒。(2)根据上述分析知,沉淀Ⅱ的成分为CaCO3、Fe(OH)3、Al(OH)3,用离子方程式表示生成沉淀的过程CO32- + Ca2+====CaCO3↓,2Fe3+ + 3CO32- + 3H2O ="===" 2Fe(OH)3↓ + 3CO2↑,2Al3+ + 3CO32- + 3H2O====2Al(OH)3↓ + 3CO2↑;(3)纯碱溶液中所有离子浓度的大小关系为c(Na+)>c(CO32—)>c(OH-)>c(HCO3—)>c(H+)。(4)利用公式c=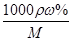 将题给数据代入计算,纯碱溶液的物质的量浓度为1 mo1·L-1。
将题给数据代入计算,纯碱溶液的物质的量浓度为1 mo1·L-1。
考点:考查化学实验基本操作,物质的制备方案的设计、评价,物质的的分离提纯,离子方程式的书写,离子浓度大小比较,物质的量浓度的计算。
本题难度:一般
2、填空题 (8分)
Ⅰ.醋酸是常见的弱酸。用0.1 mol?L—1NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol?L—1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH体积而变化的两条滴定曲线。
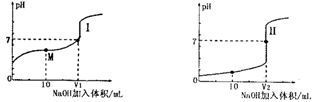
(1)滴定醋酸的曲线是 (填“I”或“Ⅱ”)。
(2)滴定开始前,三种溶液中由水电离出的c(H+)最大的溶液名称是 。
(3)V1和V2的关系:V1 V2(填“>”、“=”或“<”)
(4)M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是 。
Ⅱ.草酸钴是制备钴的氧化物的重要原料。下图为二水合草酸钴(CoC2O4?2H2O)在空气中受热的质量变化曲线,曲线中300 ℃及以上所得固体均为钴氧化物。

(1)通过计算确定C点剩余固体的化学成分为 (填化学式)。试写出B点对应的物质与O2在225 ℃~300 ℃发生反应的化学方程式: 。
(2)取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480 mL5 mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比 。
参考答案:(8分)
I、(1)I (2)
本题解析:
试题分析:Ⅰ、(1)醋酸是弱酸,浓度为0.1 mol?L—1醋酸溶液的PH>1,所以滴定醋酸的曲线是I;
(2)NaOH、HCl、CH3COOH 的浓度相等,均为0.1 mol?L—1,NaOH、HCl属于强碱、强酸,CH3COOH 是弱酸,电离出的c(H+)的浓度较小,对水的电离程度抑制的小,所以滴定开始前,三种溶液中由水电离出的c(H+)最大的溶液名称是醋酸。
(3)当酸碱恰好反应时,盐酸和醋酸消耗NaOH溶液的体积相等,醋酸钠属于强碱弱酸盐,溶液显碱性,当两溶液呈中性时,向醋酸中滴加NaOH的体积要少,所以V1 <V2 .
(4)M点是醋酸钠和醋酸的等浓度混合溶液,溶液显酸,醋酸的电离程度大于CH3COO-的水解程度,则M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是c(CH3COO-)>c (Na+)>c (H+)>c (OH-)。
Ⅱ、(1)由题意知,二水合草酸钴(CoC2O4?2H2O)的起始质量是18.3g,物质的量为0.1mol,其中Co元素的质量是5.9g,300℃时该固体分解为Co的氧化物,C点固体质量为8.03g,则O元素的质量是8.03g-5.9g=2.13g,物质的量是2.13g/16g?mol-1=0.133125mol,则该固体中Co与O原子的物质的量之比是0.1: 0.133125="3:4," C点剩余固体的化学成分为Co3O4,B点对应的物质的质量是14.70g,与起始的固体质量相比减少18.3-14.7=3.6g,恰好为结晶水的质量,所以B点对应的物质是草酸钴,与氧气在225 ℃~300 ℃发生反应的化学方程式为3CoC2O4+2O2 = Co3O4+6CO2;
(2)设该钴的氧化物中-3价Co的原子个数是x,与盐酸反应得到的黄绿色气体为氯气,物质的量是4.48/22.4=0.2mol,则反应中失去电子的物质的量是0.4mol,Co最终都变为 +2价,则-3价Co得到电子的物质的量是x=0.4,480mL5mol/L盐酸中氯离子的物质的量是0.48L×5mol/L=2.4mol,被氧化的氯离子的物质的量是0.4mol,所以溶液中还余氯离子的物质的量是2.4-0.4=2.0mol,根据氯元素守恒,所以CoCl2的物质的量是1.0mol,则钴的氧化物中+2价钴的物质的量是1.0-0.4=0.6,根据正负化合价的代数和为0,则钴的氧化物中O元素的物质的量是(0.4×3+0.6×2)÷2=1.2mol,所以钴氧化物中Co、O的物质的量之比5:6。
考点:考查酸碱中和滴定,草酸钴的化学性质等知识。
本题难度:困难
3、选择题 25℃时,水中存在电离平衡:H2O?

?H++OH-△H>0.下列叙述正确的是( )
A.将水加热,Kw增大,pH不变
B.向水中加入少量NaHSO4固体,c(H+)增大,Kw不变
C.向水中加入少量NaOH固体,平衡逆向移动,c(OH-)降低
D.向水中加入少量NH4Cl固体,平衡正向移动,c(OH-)增大
参考答案:B
本题解析:
本题难度:简单
4、选择题 经测定某溶液中离子只有Na+、CH3COO-、H+、OH-四种,且离子浓度大小的排列顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。其可能的情形是
A.该溶液由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成
B.在上述溶液中加入适量NaOH,可能使溶液中离子浓度大小改变为:
c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C.0.1mol/L的CH3COOH溶液与0.2mol/L的NaOH溶液等体积混合
D.该溶液由0.1mol/L的CH3COOH溶液与等物质的量浓度等体积的NaOH溶液混合而成
参考答案:A
本题解析:略
本题难度:一般
5、选择题 某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示。
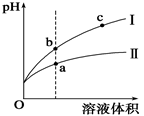
据图判断正确的是
A.Ⅱ为盐酸稀释时的pH值变化曲线
B.b点酸的总浓度大于a点酸的总浓度
C.a点Kw的数值比c点Kw的数值大
D.b点溶液的导电性比c点溶液的导电性强
参考答案:D
本题解析:
试题分析: A由于弱酸存在电离平衡,相同pH、相同体积的盐酸和醋酸溶液分别加水稀释时,醋酸的酸性降低的相对慢一些,从图像可知I线表示盐酸稀释,II线表示醋酸稀释,A错误;B. 由于两酸的PH相同,盐酸的浓度小,稀释相同倍数,仍然是醋酸的浓度大于盐酸,C错误; C:温度相同的情况下,KW是定值,C错误;D.b点溶液稀释后可变成c点溶液,c点溶液中离子浓度小,导电性差,D正确;选D。
考点:考查弱电解质的电离。
本题难度:一般