微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度(℃)
| 10
| 20
| 30
| 加热煮沸后冷却到50℃
|
pH
| 8.3
| 8.4
| 8.5
| 8.8
甲同学认为,该溶液的pH值升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为 。
乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度 (填“大于”或“小于”)NaHCO3。
丙同学认为甲、乙的判断都不充分。丙认为:___________________________
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则 (填“甲”或“乙”)判断正确。试剂X是 。
A、Ba(OH)2溶液 B、BaCl2溶液 C、NaOH溶液 D、澄清石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则 (填“甲”或“乙”)判断正确。
(3)常温下,在测得PH都等于9的NaOH溶液和Na2CO3溶液中,由水电离的OH—浓度分别为amol /L和bmol /L,则a与b的比值= 。
2、填空题 (1)某温度时,测得0.01 mol·L-1的NaOH溶液的pH为11,则该温度下水的离子积常数Kw=________。
(2)在此温度下,将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合。
①若所得混合液为中性,且a=12,b=2,则Va∶Vb=________。
②若所得混合液的pH=10,且a=12,b=2,则Va∶Vb=________。
3、填空题 设水的电离平衡线如图所示。

(1)若以A点表示25℃时水在电离平衡时的粒子浓度,当温度升高到100℃时,水的电离平衡状态到B点,则此时水的离子积从___________增加到____________;
(2)将PH=8的Ba(OH)2溶液与PH=5的稀盐酸混合,并保持在100℃的恒温,欲使混合溶液的PH=7,则
Ba(OH)2溶液和盐酸的体积比为__________。
4、选择题 某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是
A.该溶液可由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成
B.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
C.加入适量的NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH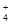 )之和 )之和
5、选择题 下列说法正确的是( )
A.pH=7的溶液一定显中性
B.pH=6的溶液一定显酸性
C.c(H+)<c(OH-)的溶液一定显碱性
D.c(OH-)=1×10-6 mol/L的溶液一定显酸性
|