微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某实验探究小组根据乙醛还原新制Cu(OH)2的实验操作和实验现象。对反应方程式
“CH3CHO+2Cu(OH)2 CH3COOH+Cu2O +2H2O”提出了质疑,并进行如下探究:
CH3COOH+Cu2O +2H2O”提出了质疑,并进行如下探究:
(一)查阅资料
(1)质量分数为10%的NaOH溶液密度为1.1 g/cm3,该溶液的c(NaOH)=_________mol/L;质量分数为2%的
CuSO4溶液密度为1.0 g/cm3,其c(CuSO4) =0.125 mol/L。
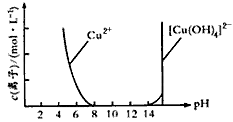
(2) Cu(OH)2可溶于浓的强碱溶液生成深蓝色的[Cu(OH)4]2-溶液。CuSO4溶液与NaOH溶液反应过程中Cu2+与[Cu(OH)4]2-浓度变化如下图所示:
(3)Cu2O、CuO均可溶于CH3COOH;在溶液中可发生2Cu+=Cu+Cu2+反应。
(二)实验操作及实验现象
(1)在2 mL10%的NaOH溶液中滴加4~6滴(约0.2 mL)2% CuSO4溶液,经测定混合溶液中c(OH-)约为 2.5 mol/L。
(2)若对上述混合物进行过滤,可得到浅蓝色的_________ (填化学式)固体,滤液呈深蓝色,则显深蓝色的离子是____________ (填离子符号)。
(3)在第(1)步所得的混合物中加入0.5mL乙醛,加热至沸腾,产生砖红色沉淀。
(三)对"CH3CHO+2Cu(OH)2 CH3COOH+Cu2O+2H2O”质疑的理由:
CH3COOH+Cu2O+2H2O”质疑的理由:
(1)______________; (2)________________
(四)结论:根据上述探究,乙醛与新制Cu(OH)2反应的离子方程式为____________________
参考答案:(一)(1)2.75
(二)(2)Cu(OH)2;[C
本题解析:
本题难度:困难
2、实验题 全世界每年被腐蚀损耗的钢铁量非常惊人,在潮湿空气中发生吸氧腐蚀是钢铁腐蚀的主要原因。
(1)在潮湿空气中,钢铁发生吸氧腐蚀时的负极反应的电极反应式为_____________。
(2)已知草酸(H2C2O4)分解的化学方程式为:H2C2O4  CO↑ + CO2↑ + H2O,
CO↑ + CO2↑ + H2O,
下列装置中,可用作草酸分解制取气体的是______(填答案编号)。

(3)某实验小组为测定铁锈样品的组成(假定铁锈中只有Fe2O3·nH2O和Fe两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如下图所示。

①为得到干燥、纯净的CO气体,洗气瓶A、B中盛放的液态试剂依次可能是_______、
________(填答案编号)。
a.浓硫酸????b.澄清的石灰水???? c.氢氧化钠溶液???d.无水氯化钙
②在点燃C处酒精灯之前应进行的操作是:(a)检查装置气密性;(b)____________。
③E装置的作用是______________________________________________________,
上述装置最后尾气处理的方法是_____________。
④准确称量样品的质量10.00g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为8.32 g,D中浓硫酸增重0.72 g,则n =_____________。
⑤在本实验中,下列情况会使测定结果n偏大的是__________(填答案编号)。
a.缺少装置B? b.缺少装置E ? c.反应后的固体中有少量Fe2O3·nH2O
参考答案:1) Fe—2e-- = Fe2+?(2分)
(2)(
本题解析:略
本题难度:一般
3、实验题 将绿矾(FeSO4.7H2O)隔绝空气条件下强热分解,已知产物全部为氧化物,为探究绿矾分解的反应产物,某同学进行了以下实验 :
实验一:为探究固体产物中Fe元素的价态,该同学将固体产物溶于足量的稀H2SO4得到相应溶液,进行以下猜想和实验
猜想
| 实验操作
| 预期现象
|
猜想一:Fe元素只显______价
| ①向所得溶液中滴入KSCN溶液
②向稀酸性KMnO4溶液中滴入所得溶液
| KSCN溶液无明显现象
|
猜想二;Fe元素只显______价
| 稀酸性KMnO4溶液颜色_____
|
猜想三:Fe元素既有+2价又有+3价
| KSCN溶液呈______色
稀酸性KMnO4溶液颜色______
?
实验二:为进一步探究该反应的产物,进行了如下图所示的实验
①实验开始时,点燃B处酒精喷灯之前应先打开A处活塞通CO2,其目的是????????
???????????。
②装置图中C的作用是?????????????????。
③该组同学称取了55.6克绿矾按如图装置进行试验,待绿矾分解完全后,测得D瓶中沉淀的质量为23.3克,根据这些数据,可以得知,绿矾分解的化学方程式为_____________
④该组同学设计的装置存在着一个明显的缺陷是?????????????????????????????????????
参考答案:
猜想一:+2
猜想二: +3?褪为无色
本题解析:略
本题难度:简单
4、实验题 某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
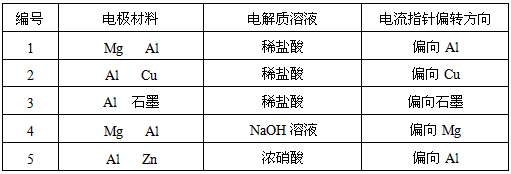
试根据上表中的实验现象回答下列问题:
(1)实验1、2中Al所作的电极是否相同?____________。
(2)写出实验3中的电极反应式。
铝为( )_____________________________________;
石墨为( )___________________________________;
(3)实验4中的铝作正极还是负极?写出电池总反应方程式。
________________________________________
(4)解释实验5中电流指针偏向铝的原因。
________________________________________
(5)根据实验结果总结:在原电池中金属铝作正极还是作负极受哪些因素的影响?
________________________________________
参考答案: (1)不同
(2)负极;2Al-6e-==2Al
本题解析:
本题难度:困难
5、简答题 某校研究性学习小组同学在实验时把SO2通入装有1mol/L BaCl2溶液的试管中,出现了白色浑浊物.
(1)实验小组的同学根据沉淀溶解平衡原理查阅了工具书上的相关数据,经过计算推导得出:常温下即使把SO2通入1mol/LBaCl2溶液中至饱和,也不可能生成BaSO3沉淀,故白色浑浊物只能是BaSO4.你认为所查阅的数据为:BaSO3的溶度积或BaSO3的溶解度或Ksp(BaSO3).
(2)二氧化硫通入氯化钡溶液中理论上不产生沉淀,而实际受到空气和溶液氧气的影响很快便能观察到沉淀现象.为了避免产生沉淀,某化学小组设计了如下验装置,实验操作步骤如图:

①气密性检查完好后,在装置A中的多孔隔板上放上锌粒,通过长颈漏斗注入稀硫酸.打开活塞,将产生的氢气导入到后续装置.
②D中气泡均匀冒出并验纯D中气泡均匀冒出后后关闭活塞,将装置D的导管插入烧杯中.
③通过装置B的分液漏斗滴加浓硫酸,产生的气体进入到BaCl2溶液中,溶液保持澄清.
④打开活塞,将产生的氢气导入后续装置一段时间.
⑤将盛有BaCl2溶液的试管从装置中取出,拔去橡皮塞用胶头滴管伸入到苯层下方滴加双氧水,随即出现白色浑浊,滴加稀盐酸并振荡,白色浑浊不消失.
⑥拆卸装置,清洗仪器,处理剩余药品.
请回答下列问题
(2)实验步骤①和③的空白处使用的仪器名称分别为______、分液漏斗;
(3)反应开始前,先向制取SO2的装置中通入纯净的A中产生的氢气,其作用是:______.
(4)装C中苯的作用是______,
(5)装置D的目的除去SO2防止污染______;
(6)写出实验步骤⑤试管中发生反应的化学方程式______、SO2+H2O2=H2SO4、H2SO4+BaCl2=BaSO4↓+2HCl.
参考答案:(2)可以通过长颈漏斗实现锌粒和酸的接触,分液漏斗的结构和长
本题解析:
本题难度:一般
|