微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)右图为实验室某浓盐酸试剂瓶标签上的有关数据,根据有关数据回答下列问题:
盐酸
分子式:HCl
相对分子质量:36.5
密度:1.19g/m3
质量分数:36.5%
(1)该浓盐酸中HCl的物质的量浓度为?????????mol/L。
(2)取用任意体积的该盐酸溶液时,下列物理量不随所取体积多少??????????????而变化的是??????????????。
A、溶液中HCl的质量????? B、溶液的p H
C、溶液中H+的数目??????? D、溶液的密度
(3)欲配制上述浓盐酸,需要在1L水中通入标态下???????????L
HCl气体(保留1位小数)
(4)现有1L1mol/L的稀盐酸,欲使其浓度增大1倍,采取的措施合理的是??????????????。
A、通入标况下HCl气体22.4L????????????? B、将溶液加热浓缩至0.5L?
C、加入5mol/L的盐酸0.6L,再稀释至2L。? D、加入1L 3mol/L的盐酸混合均匀。
参考答案:(1)11.9mol/L(2分)????(2)BD(2分)<
本题解析:略
本题难度:简单
2、实验题 下图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。

(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的离子反应方程式为?????????????????;
装置B中饱和食盐水的作用是_________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象???????????????????????????????????;
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入????????????????;
?
| a
| b
| c
| d
| I
| 干燥的有色布条
| 干燥的有色布条
| 湿润的有色布条
| 湿润的有色布条
| II
| 碱石灰
| 硅胶
| 浓硫酸
| 无水氯化钙
| III
| 湿润的有色布条
| 湿润的有色布条
| 干燥的有色布条
| 干燥的有色布条
?
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为__________色,说明 ???????????????????????????????????????????????????;
打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是 ?????????????????????????????;
(4)装置F中用足量的NaOH溶液吸收余氯,试写出相应的离子方程式 ????????????????????????????;
参考答案:(1)MnO2+4H++2Cl? 本题解析: 本题解析:
试题分析:(1)由化学方程式改写可得离子方程式;饱和食盐水可吸收HCl,装置B中饱和食盐水的作用是除去Cl2中的HCl;若装置C堵塞,B中压强增大,长颈漏斗中液面会上升,形成水柱。
(2)装置C的实验目的是验证氯气是否具有漂白性,要验证干燥氯气无漂白性可用湿润的有色布条,氯气和水反应生成次氯酸具有漂白性,选项中abc的Ⅱ中都是干燥剂,再通入湿润的有色布条不能验证氯气的漂白性,所以C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,所以选d。
(3)当向D中缓缓通入少
本题难度:一般
3、填空题 Q、R、X、Y、Z为周期表前四周期元素,原子序数依次递增。已知:
①Q为元素周期表中原子半径最小的元素;
②R的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;
③Y的基态原子的核外成对电子数是未成对电子数的3倍;
④Q、R、Y三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,Q、R两种元素组成的原子个数比为1:1的化合物N是中学化学中常见的有机溶剂;
⑤Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同。
请回答下列问题(答题时,Q、R、X、Y、Z用所对应的元素符号表示)
(1)化合物M的空间构型为___________,其中心原子采取___________杂化;化合物N在固态时的晶体类型为___________。
(2)R、X、Y三种元素的第一电离能由小到大的顺序为___________;
(3)由上述一种或多种元素组成的与RY2互为等电子体的分子为___________(写分子式)
(4)由R、X、Y三种元素组成的RXY-离子在酸性条件下可与NaClO溶液反应,生成X2、RY2等物质。该反应的离子方程式为_____________________________。
(5)Z原子基态时的外围电子排布式为___________;Z的一种含氧酸钡盐的晶胞结构如图所示,晶体内与每个Z原子等距离且最近的氧原子数为___________
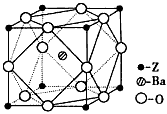
参考答案:(1)平面三角形;sp2;分子晶体
(2)C<O
本题解析:
本题难度:困难
4、简答题 某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应).请回答下列问题:
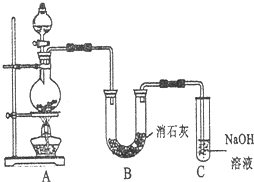
(1)A为实验室制氯气的发生装置,某学生用12mo1?L-1的浓盐酸100mL和足量的MnO2反应制Cl2.
(2)写出制漂白粉化学方程式是______.
(3)此实验所得漂白粉的有效成分偏低.该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应:
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是______.
②避免另一个副反应的发生,可将装置作何改进______.
参考答案:(2)因氯气与消石灰反应生成氯化钙、次氯酸钙和水,
化
本题解析:
本题难度:一般
5、选择题 下列事实,不能说明氯元素的非金属性比硫元素强的是
A.氯气比硫单质更易与氢气反应
B.HClO4酸性比H2SO4强
C.盐酸是强酸,氢硫酸是弱酸
D.受热时,氯化氢比硫化氢稳定
参考答案:C
本题解析:非金属性的比较规律:
1、由元素原子的氧化性判断:一般情况下,氧化性越强,对应非金属性越强。
2、由单质和酸或者和水的反应程度判断:反应越剧烈,非金属性越强。
3、由对应氢化物的稳定性判断:氢化物越稳定,非金属性越强。
4、由和氢气化合的难易程度判断:化合越容易,非金属性越强。
5、由最高价氧化物对应水化物的酸性来判断:酸性越强,非金属越强。(除氟元素之外)
6、由对应阴离子的还原性判断:还原性越强,对应非金属性越弱。
7、由置换反应判断:强置弱。〔若依据置换反应
本题难度:简单
|
|