微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用0.20mol/L的NaOH溶液滴定100.0mL0.20mol/LHCl溶液时,滴定误差在±0.1%以内,反应完毕后溶液的pH变化范围是
A.5~9
B.4.0~10.0
C.4.3~9.7
D.以上都不正确
参考答案:B
本题解析:
试题分析:(1)计量点前计量点前误差为+0.1%时,即滴入NaOH的体积为99.9mL,NaOH不足。
此时锥形瓶溶液中是中和生成的NaCl和剩余的HCl。所以只要计算该溶液的PH值即可。
剩余的n(HCl)=n(HCl总)-n(NaOH)=0.2*(100.00-99.9)*10^-3=2*10^-6(mol)
则PH(前)=lg[c(HCl)]=4。
(2)计量点后半滴,即加入NaOH的体积为100.1mL,NaOH过量,此时为NaCl和NaOH的混合溶液,所以计算时只需考虑NaOH即可。
n(NaOH过量)=n(NaOH总)-n(NaOH反应)=0.2*(100.1-100)*10^-3)=2*10^-5(mol)
此时溶液体积v=100.00+100.1=200.1mL=200.1*10^-3(L),
所以[OH-]=n(NaOH过量)/v="2*10^-5/(200.1*10^-3)=1/100.05" *10^-2(mol/L)
[H+]=10^-14/[OH-]? PH(后)=-lg[H+]=10所以突跃范围为4~10。故选B。
点评:酸碱中和滴定突跃范围的计算实际上也是强酸、强碱互相混合的计算,其规律是
(3)酸I+碱II
完全中和:[H+] =" [OH-]" = 1 mol/L
mol/L
酸过量:? [H+]= 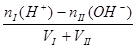
碱过量:[OH-] = 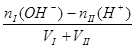
滴定突跃范围指计量点前半滴和后半滴滴定剂所引起的锥形瓶中溶液PH值的变化范围。要控制误差为+/-0.1%时。由于计量点时酸碱恰好完全反应,也就是滴入NaOH的体积为100.00mL时达计量点,所以计量点前误差为+0.1%时,是指加入NaOH的体积为99.9mL,而计量点后误差为-0.1%时指加入NaOH的体积为100.1mL。因此计算滴定突跃范围,只要计算出计量点前、后半滴时锥形瓶中溶液的PH(前)和PH(后)即可。
本题难度:简单
2、实验题 Cl2和H2O2是高中阶段最常见的两种氧化剂,经查阅资料Cl2氧化能力强于H2O2,能将H2O2氧化。为了验证该结论,学生设计了如下图所示的实验装置进行实验(夹持装置略去)。圆底烧瓶A中的反应方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,请回答下列问题
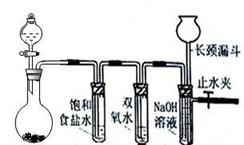
A?????????B ?????C??????D
(1)试管B中饱和食盐水的作用??????????????????;
(2)试管C中加入5mL 30% 双氧水,发生反应的化学方程式____________________;
(3)试管D中充满10% NaOH溶液,NaOH溶液的作用是??????????????????;
(4)将浓盐酸注入圆底烧瓶A,当装置中的空气基本排尽后关闭止水夹,反应一段时间后试管D中的现象为????????????????,试管D中的气体检验方法为__________________;
(5)有的同学对上述实验中试管D中气体来源产生质疑,你认为可能的来源有??????????????????????????????????????????????????????(用化学方程式表示),对于质疑可以采用对比实验来解决。
参考答案:(1)除去Cl2中混有的HCl;(2)Cl2+H2O2=2H
本题解析:
试题分析:(1)氯化氢极易溶于水,氯气能溶于水,且与水反应,Cl2+H2O=H++Cl-+HClO,食盐水溶液中的氯离子抑制氯气的溶解,降低氯气的溶解度,故饱和食盐水的作用是除去Cl2中混有的HCl;(2)Cl2氧化能力强于H2O2,能将H2O2氧化产生O2,化学方程式Cl2+H2O2=2HCl+O2(3)有少量的Cl2没有发生反应排出,用NaOH溶液吸收多余的Cl2(4)将浓盐酸注入圆底烧瓶后产生大量的氯气,后与双氧水反应生成大量的氧气,D中装置中空气排今后止水夹关闭,D装置内压强增大使液面下降,长颈漏斗中液面上升;检验氧气的方法,使带火星的木条复燃(5)2H2O2=2H2O+O2↑;Cl2+H2O=HCl+HClO,2HClO=2HCl+O2↑。
本题难度:一般
3、实验题 某化学实验小组同学利用以下装置制备氨气,并探究氨气的性质(部分仪器已略去)。请回答下列问题:
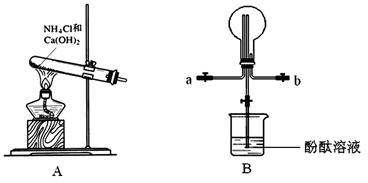
(1)实验室制备氨气的化学方程式为??????????????????????????????;干燥氨气常用的干燥剂是???????????????。
(2)收集氨气时,请你选择氨气的进气口????????(填“a”或“b”)。
(3)①、若观察到装置B中的烧瓶内产生了红色喷泉,则说明氨气具有的性质是?????????????????????????????????????????????。
②、若装置B中的烧瓶充满干燥气体,烧杯中盛有液体,下列组合中不可能形成喷泉的是??????????
A、HCl和H2O?????? B、H2和H2O??????? C、CO2和NaOH?
(4)氨气在催化剂并且加热时会被空气氧化,这是工业制硝酸的第一步反应,写出该反应的化学方程式?????????????????????????????????。
参考答案:(1)2NH4Cl+Ca(OH)2==2NH3↑+2H2O+
本题解析:
试题分析::(1)实验室用加热氯化氨和消石灰的固体混合物制取氨气,故答案为:2NH4Cl+Ca(OH)2 2NH3↑+2H2O+CaCl2;得到的氨气为碱性气体,可以用碱石灰(碱性干燥剂,氢氧化钠固体和氧化钙的混合物)干燥。
2NH3↑+2H2O+CaCl2;得到的氨气为碱性气体,可以用碱石灰(碱性干燥剂,氢氧化钠固体和氧化钙的混合物)干燥。
(2)氨气的式量为17,空气的平均式量为29,氨气密度小于空气的密度,所以要采用向下排空气法收集氨气,即a?为进气口,b为出气口,故答案为:a;
(3)①、氨气溶于水生成氨水,氨水电离出自由移动的氢氧根离子,所以溶液呈碱性,加入酚酞后溶液呈红色;
②、氨气形成喷泉的原理是由于氨气极易溶于水,氨气溶于水而导致烧瓶内压强减小,从而形成喷泉。依据氨气形成喷泉的原理,如要形成喷泉,烧瓶内气体溶于水导致烧瓶内压强减小,外界大气压将烧杯内液体压入到烧瓶内,从而形成喷泉;因为H2不溶于水,不能形成喷泉,所以本题选B。
(4)氨催化氧化法制硝酸的步骤:氨气催化氧化为一氧化氮、一氧化氮和氧气反应生成二
氧化氮、二氧化氮和水反应生成硝酸,故答案为:4NH3+5O2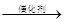 4NO+6H2O。
4NO+6H2O。
点评:本题考查氨气的制取和性质等知识,题目较为综合,具有一定难度,熟练掌握实验室中制取氨气的反应原理,氨气的性质是解答本题的关键。
本题难度:一般
4、实验题 (12分)I.在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙和一种氮肥。请根据要求答问题:
(1)写出该反应的化学方程式????????????????????????????????????????。
(2)如何判断所得碳酸钙是否为纳米级?????????????????????????????????。
Ⅱ.某实验小组设计下图装置测定SO2转化成SO3的转化率。已知SO3的熔点16.8℃,沸点是44.8℃。已知发生装置中反应的化学方程式为:
Na2SO3(s)+H2SO4
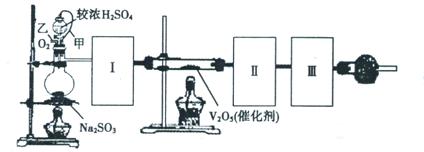
(1)根据实验需要,请从下图A~E装置中选择最适合装置,连接在I、Ⅱ、Ⅲ处。
Ⅰ???????????Ⅱ???????????Ⅲ??????????。
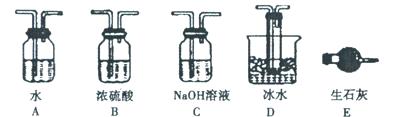
(2)在检查完装置气密性后,从乙处均匀通入O2,在实验中先加热催化剂后滴加浓硫酸,这样操作后在装置I和装置Ⅱ之间发生的反应的化学方程式???????????????????。
(3)发生装置的分液漏斗上接橡皮管甲的目的是???????????????????????????????。
(4)用126g Na2SO3粉末与足量浓硫酸进行实验,当反应结束时,继续通入O2一段时间,若测得装置Ⅲ增重了51.2g,则实验中SO2的转化率为???????????????。
参考答案:(本题12分)
I.(1)CaCl2+CO2+2NH3
本题解析:I.(1)根据原子守恒可知,另一种氮肥应该是氯化铵,所以该反应的化学方程式是CaCl2+CO2+2NH3+H2O=CaCO3↓+2NH4Cl。
(2)由于纳米材料的微粒直径介于1nm和100纳米之间,所以纳米材料形成的分散系应该是胶体,而检验是否为胶体的方法是丁达尔效应。即用一束光照射,若出现一条光亮的通路,则是纳米级碳酸钙,否则不是。
II.(1)根据题意可知,实验原理是利用生成的SO2被氧化生成三氧化硫,然后然后分别通过测量剩余的SO2和生成的三氧化硫即可测定SO2转化成SO3的转化率。由于生成的SO2中含有水蒸气,因此首先要干燥SO2,选择浓硫酸。由于三氧化硫的熔点低,剩余通过冰水来来收集生成的三氧化硫,最后剩余的SO2用氢氧化钠溶液吸收,剩余正确的答案选B、D、C。
(2)在催化剂的作用下,SO2被氧化生成三氧化硫,反应的化学方程式是2SO2+ O2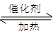 2SO3。
2SO3。
(3)由于在反应中生成气体SO2,所以必须保持内外压强相等,以使浓硫酸顺利滴下,所以作用是使分液漏斗和烧瓶内气压平衡,保证较浓硫酸能够顺利流下。
(4)126g Na2SO3固体可以生成1molSO2,质量是64g,而剩余的SO2气体是51.2g,所以实验中SO2的转化率为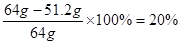 。
。
本题难度:一般
5、选择题 下列关于实验室制取气体所用试剂的组合不合理的是
A.制Cl2:MnO2、盐酸(浓)
B.制H2:硫酸(稀)、Zn
C.制O2: MnO2、H2O2
D.制CO2:硫酸(稀)、CaCO3
参考答案:D
本题解析:制取气体所用试剂的组合不合理的是制CO2:应用稀盐酸和碳酸钙反应,不能用硫酸,因为硫酸和碳酸钙反应生成硫酸钙是微溶物,会附着在碳酸钙表面,使反应终止。故选D
本题难度:一般