微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如图是温度和压强对X+Y?2Z?反应影响的示意图.图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数.下列叙述正确的是( )
A.上述可逆反应的正反应为放热反应
B.X、Y、Z均为气态
C.X和Y中只有一种是气态,Z为气态
D.上述反应的正反应的△H>0

参考答案:A.图象曲线变化可知,随着温度的升高,Z的体积分数增大,说明
本题解析:
本题难度:一般
2、选择题 两气体A、B分别为0.6mol、0.5mol。在0.4L密闭容器中发生反应:3A+B mC+2D,经5min后达到平衡,此时C为0.2mol。又知在此反应时间D的平均反应速率为0.1mol·L-1·min-1,以下结论正确的是??????????????(???)
mC+2D,经5min后达到平衡,此时C为0.2mol。又知在此反应时间D的平均反应速率为0.1mol·L-1·min-1,以下结论正确的是??????????????(???)
A.m值为3 ?????????
B.B的转化率为20%???????
C.A的平均反应速率为0.1mol·L-1·min-1???????
D.平衡时反应混合物总物质的量为1mol
参考答案:B
本题解析:3A+B mC+2D
mC+2D
n始? 0.6mol、0.5mol?????? 0?? 0
n变??0.3mol? 0.1mol?? 0.1m??? 0.2mol
n平???0.3mol? 0.4mol?? 0.1m??? 0 .2mol
0.1m? =? 0.2mol??? m=1B的转化率为
本题难度:简单
3、填空题 (14分)硝酸厂废气、汽车尾气中的氮氧化物可污染大气,现有几种消除氮氧化物的方法如下:
目前,消除氮氧化物污染有多种方法。
(1)方法一:CH4催化还原法。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2
③H2O(g)=H2O(l) ΔH3=-44 kJ·mol-1
现有一混合气体中NO与NO2的体积比为3:1,用22.4L(标准状况下)甲烷气体催化还原该混合气体,恰好完全反应(已知生成物全部为气态),并放出1013.5KJ的热量,则ΔH2为______;写出CH4(g)与NO2(g)反应生成N2(g) 、CO2(g)和H2O(l)的热化学方程式_______________________。
(2)方法二:活性炭还原法。
某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,只生成甲和乙,甲和乙均为参与大气循环的气体,且反应进行到不同时间测得各物质的浓度如下:
 物质的量/mol 物质的量/mol
时间/min
| NO
| 甲
| 乙
|
0
| 0.200
| 0
| 0
|
10
| 0.116
| 0.042
| 0.042
|
20
| 0.080
| 0.060
| 0.060
|
30
| 0.080
| 0.060
| 0.060
由以上信息可知:
①该原理的化学方程式为____________________________________________________.
②该温度下的平衡常数K=_____________________________。(保留小数点后两位有效数字)
③若20min后升高温度至T2℃,达到平衡后,若容器中NO、甲、乙的浓度之比为1:1:1,
则该反应的ΔH_______ 0 。(填">"、"<"、"=")
(3)方法三:NH3催化还原氮氧化物(SCR技术)。该技术是目前应用最广泛的烟气氮氧化物脱除技术。
反应原理为:2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g) 每生成1molN2转移的电子数为_____________________________________________________________。 2N2(g)+3H2O(g) 每生成1molN2转移的电子数为_____________________________________________________________。
(4)方法四:ClO2氧化氮氧化物。其转化流程如下:

已知反应Ⅰ的化学方程式为2NO+ ClO2+ H2O = NO2+ HNO3+ HCl,则反应Ⅱ的化学方程式是 。
参考答案:(14分)
(1)-1160kJ/mol &
本题解析:
试题分析:(1)22.4L标准状况下的甲烷物质的量为1mol,设混合气体中NO2 xmol,NOymol,根据①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1 ②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2
列方程为3x="y" 、x/4+y/4="1" 解得x=1,y=3,根据574/4+(|ΔH2|/4)×3=1013.5 解得ΔH2=-1160kJ/mol;根据盖斯定律,(①+②)÷2+③×2=(-574 kJ·mol-1-1160kJ/mol)÷2+(-44 kJ·mol-1)×2=-955 kJ·mol-1, CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l) ΔH=-955 kJ·mol-1。
(2)①C与NO反应生成两种参与大气循环的气体,该气体是氮气和CO2,所以化学方程式为C(s)+2NO(g) N2(g)+CO2(g); N2(g)+CO2(g);
②反应达平衡时,各气体的物质的量为NO:0.080mol,N2:0.06mol,CO2:0.06mol,设容器的体积为1L,根据C(s)+2NO(g) N2(g)+CO2(g),K=(0.06×0.06)÷(0.08×0.08)=0.56; N2(g)+CO2(g),K=(0.06×0.06)÷(0.08×0.08)=0.56;
③20min时,容器中NO、甲、乙的浓度为0.08、0.06、0.06,20min后,升高温度,各物质的浓度之比为1:1:1,说明平衡正向移动,而升高温度,平衡向吸热反应方向进行,则该反应的ΔH>0.
(3)根据2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g)转移6e-,每生成1molN2转移的电子数为3NA。 2N2(g)+3H2O(g)转移6e-,每生成1molN2转移的电子数为3NA。
(4)根据物质转化的流程图可知,反应Ⅰ的化学方程式为2NO+ ClO2+ H2O = NO2+ HNO3+ HCl,向反应后的物质中加入Na2SO3水溶液,生成N2,说明NO2中N元素的化合价降低,做氧化剂,而Na2SO3中的硫元素化合价升高,做还原剂生成Na2SO4 ,则反应Ⅱ的化学方程式为2NO2+ 4 Na2SO3= N2+ 4Na2SO4。
考点:考查反应热的计算,盖斯定律的应用,热化学方程式的书写,化学平衡,氧化还原反应等知识。
本题难度:困难
4、填空题 在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100 mol/L、c(B)=0.200 mol/L及c(C)=0 mol/L。反应物A的浓度随时间的变化如下图所示。 C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100 mol/L、c(B)=0.200 mol/L及c(C)=0 mol/L。反应物A的浓度随时间的变化如下图所示。

请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②______________________________________________;
③______________________________________________;
(2)实验②平衡时B的转化率为________;实验③平衡时C的浓度为________________;
(3)该反应的ΔH________0,其判断理由是_________________________________;
(4)该反应进行到4.0 min时的平均反应速率:
实验②:vB=________;
实验③:vC=________。
参考答案:(1)②加催化剂 达到平衡的时间缩短,平衡时A的浓度未变 ③
本题解析:本题主要考查化学平衡,意在考查考生读图、表述和计算能力。(1)分析图像可知,①和②在平衡时刻A的浓度相等,且②的曲线斜率较大,说明反应速率较大,故是改变某一条件使反应加快,但平衡没有移动,故只可能是使用了催化剂。①和③相比较,平衡时刻③中A的浓度较小,曲线斜率较大,说明③的反应速率较大且平衡向正方向移动,而起始浓度相等,故只可能是升高温度。
(2)由起始到平衡时刻Δc(A)=0.10 mol·L-1-0.060 mol·L-1=0.040 mol·L-1,故Δc(B)=0.080 mol·L-1,则
本题难度:一般
5、选择题 应2X(g)+Y(g)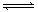 2Z(g);△H<0(正反应为放热反应)。在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量[n(Z)]与反应时间(t)的关系如图所示。则下列判断正确的是 2Z(g);△H<0(正反应为放热反应)。在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量[n(Z)]与反应时间(t)的关系如图所示。则下列判断正确的是
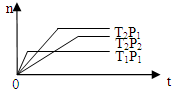
A.T1<T2,P1<P2
B.T1<T2,P1>P2
C.T1>T2,P1>P2
D.T1>T2,P1<P2
参考答案:C
本题解析:本题属于中等题,根据化学平衡图像,先拐先平原理,其它条件不变的情况下,增大压强,化学反应速率加快,所以P1>P2。其它条件不变的情况下,升高温度,化学反应速率加快,所以T1>T2
本题难度:一般
|