微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 氢离子浓度都为1×10—2mol/L的盐酸和醋酸各100 mL分别稀释2倍后,再分别加入0.03 g锌粉,在相同条件下充分反应,有关叙述正确的是
A.醋酸与锌反应放出氢气多
B.盐酸和醋酸分别与锌反应放出的氢气一样多
C.刚开始反应时,醋酸与锌反应速率小
D.盐酸和醋酸分别与锌反应的平均速率一样大
参考答案:B
本题解析:由题意,得:酸过量,均为0.03 g锌粉完全反应,故放出的氢气一样多;
分别稀释2倍后,C0(H+):盐酸<醋酸,所以:刚开始反应时,醋酸与锌反应速率大;
反应过程中,也是C0(H+):盐酸<醋酸,所以,醋酸与锌反应速率大;
本题难度:简单
2、填空题 (14分)短周期主族元素A、B、C、D、E原子序数依次增大,A是元素周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C原子的最外层电子数是次外层电子数的3倍,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物分子含有相同的电子数。
(1)A、C、D形成的化合物中含有的化学键类型为 。
(2)已知:
① E-E→2E △H=+a kJ/mol;
② 2A→A-A △H=-b kJ/mol;
③ E+A→A-E △H=-c kJ/mol;
写出298K时,A2与E2反应的热化学方程式 。
(3)在某温度下容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g) X(g) △H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
X(g) △H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
实验
| 甲
| 乙
| 丙
|
初始投料
| 2 molA2、1 molBC
| 1 molX
| 4 molA2、2 molBC
|
平衡时n(X)
| 0.5mol
| n2
| n3
|
反应的能量变化
| 放出Q1kJ
| 吸收Q2kJ
| 放出Q3kJ
|
体系的压强
| P1
| P2
| P3
|
反应物的转化率
| 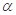 1 1
| 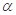 2 2
| 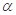 3 3
①在该温度下,假设甲容器从反应开始到平衡所需时间为4 min,则A2的平均反应速率v (A2)= 。
②计算该温度下此反应的平衡常数K = 。
③三个容器中的反应分别达平衡时下列各组数据关系正确的是 (填字母)。
A.α1+α2=1
B.Q1+Q2=Q
C.α3<α1
D.P3<2P1=2P2
E.n2<n3<1.0mol
F.Q3=2Q1
④在其他条件不变的情况下,将甲容器的体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为75%,请在下图中画出第5min 到新平衡时X的物质的量浓度的变化曲线。
(4)熔融碳酸盐燃料电池(MCFC)是一种高温燃料电池,被称为第二代燃料电池,是未来民用发电的理想选择方案之一,其工作原理如图所示。
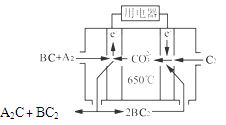
现以A2(g)、BC(g)为燃料,以一定比例Li2CO3和Na2CO3低熔混合物为电解质。写出该碳酸盐燃料电池(MCFC)正极的电极反应式____________________________。
参考答案:(14分,每空各2分)(1)离子键、极性键(或共价键)
本题解析:
试题分析:短周期主族元素A、B、C、D、E原子序数依次增大,A是元素周期表中原子半径最小的元素,则A是氢元素。B是形成化合物种类最多的元素,则B是碳元素。C原子的最外层电子数是次外层电子数的3倍,所以C是氧元素。D是同周期中金属性最强的元素,则D是钠元素,E的负一价离子与C的某种氢化物分子含有相同的电子数,因此E是氯元素。
(1)A、C、D形成的化合物是氢氧化钠,其中含有的化学键类型为离子键、极性键(或共价键)。
(2)已知:① E-E→2E △H=+a kJ/mol;② 2A→A-A △H=-b kJ/mol;③ E+A→A-E △H=-c kJ/mol,则根据盖斯定律可知①+③×2—②即得到A2与E2反应的热化学方程式H2(g)+Cl2(g)=2HCl(g) △H=(a+b-2c)kJ·mol-1。
(3)①依据原子守恒可知X是甲醇,根据表中数据可知甲中平衡时生成甲醇是0.5mol,则根据方程式可知消耗氢气是1mol,浓度是0.5mol/L,所以在该温度下,假设甲容器从反应开始到平衡所需时间为4 min,则H2的平均反应速率v (A2)=0.5mol/L÷4min=0.125mol·L-1·min-1。
②根据①中分析可知平衡时氢气、CO和甲醇的物质的量分别是1mol、0.5mol和0.5mol,浓度分别是0.5mol/L、0.25mol/L、0.25mol/L,所以该温度下此反应的平衡常数K=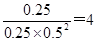 。 。
③三个容器中的反应分别达平衡时下列各组数据关系正确的是 (填字母)。
A.乙容器中的1mol甲醇换算成反应物是2mol氢气和1molCO,即甲、乙中平衡是等效的,所以α1+α2=1,A正确;B.根据以上分析可知甲、乙中平衡等效,则Q1+Q2=Q,B正确;C.丙相当于在甲的基础上增大压强,平衡向正反应方向进行,转化率增大,即α1<α3,C错误;D.丙相当于在甲的基础上将容器容积进行一般,增大压强,平衡向正反应方向进行,根据勒夏特例原理可知再次平衡时丙中压强小于甲中压强的2倍,即P3<2P1=2P2,D正确;E.根据以上分析可知n3=2n2>1.0mol,E错误; F.丙相当于在甲的基础上增大压强,平衡向正反应方向进行,则Q3>2Q1,F错误,答案选ABD。
④在其他条件不变的情况下,将甲容器的体积压缩到1L,则瞬间甲醇的浓度增大一倍,平衡向正反应方向进行,甲醇浓度开始再逐渐增大,若在第8min达到新的平衡时氢气的总转化率为75%,根据方程式可知平衡时生成甲醇2mol×0.75/2=0.75mol,浓度是0.75mol/L,所以第5min 到新平衡时甲醇的物质的量浓度的变化曲线可表示为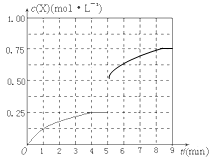 。 。
(4)燃料电池中氧气再正极得到电子,发生还原反应。由于是熔融的碳酸盐为电解质,则正极反应式为O2+4e-+2CO2=2CO32-。
考点:考查元素推断、化学键、盖斯定律、外界条件对平衡状态的影响、平衡状态计算及燃料电池应用
本题难度:困难
3、填空题 丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。已知:
①2C3H8(g)+7O2(g) =6CO(g)+8H2O(g) △H =-2389.8 kJ/mol
②2CO(g) + O2(g) =2CO2(g) △H =-566 kJ/mol
③H2O(l) = H2O(g) △H ="+" 44.0 kJ/mol
(1)写出C3H8燃烧时燃烧热的热化学方程式 。
(2)C3H8在不足量的氧气里燃烧,生成CO、CO2、H2O(g),将所有的产物通入一个体积固定的密闭容器中,在一定条件下发生如下可逆反应:CO(g) +H2O(g)  CO2(g) +H2(g)该反应的平衡常数与温度的关系如下表: CO2(g) +H2(g)该反应的平衡常数与温度的关系如下表:
温度/℃
| 400
| 500
| 800
| 平衡常数K
| 9.94
| 9
| 1
保持温度为800℃,在甲、乙两个恒容密闭容器中,起始时按照下表数据进行投料,充分反应直至达到平衡。
| H2O
| CO
| CO2
| H2
| 甲 (质量/g)
| 1.8
| 8.4
| a
| 1
| 乙 (质量/g)
| 1.8
| 2.8
| 0
| 0
①起始时,要使甲容器中反应向正反应方向进行,则a的取值范围是 ;达到平衡时,乙容器中CO的转化率为 。
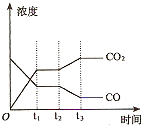
②下图表示上述甲容器中反应在t1时刻达到平衡,在t2时刻因改变某一个条件而发生变化的情况。则t2时刻改变的条件可能是 、 (答两个要点即可)。
(3)CO2可用NaOH溶液吸收得到Na2CO3或NaHCO3。
① Na2CO3溶液中离子浓度由大到小的顺序为 ;
② 已知25℃时,H2CO3的电离平衡常数K1 = 4.4×10-7 mol/L、K2 = 4.7×10-11 mol/L,当Na2CO3溶液的pH为11时,溶液中c(HCO3-)∶c(CO32-) = 。
③ 0.1 mol/L Na2CO3溶液中c(OH-) -c(H+) = [用含c(HCO3-)、c(H2CO3)的符号表示]。
参考答案:(1)C3H8(g)+5O2(g)
本题解析:
本题难度:困难
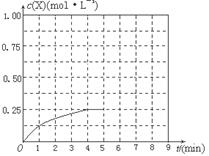
4、填空题 (6分)在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" kJ·mol-1、c(B)="0.200" kJ·mol-1及c(C)="0" kJ·mol-1。反应物A的浓度随时间的变化如下图所示。 C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" kJ·mol-1、c(B)="0.200" kJ·mol-1及c(C)="0" kJ·mol-1。反应物A的浓度随时间的变化如下图所示。
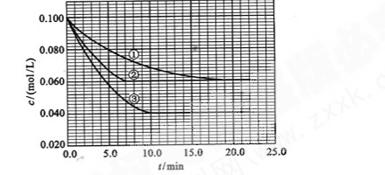
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件;所改变的条件分别:
②_______________;③_______________。
(2)实验②平衡时B的转化率为_________;该反应的△H _____0;(填“>”、“<”、或“=”)理由是_________________________________________。
(3)该反应进行到4.0min时的平均反应速率:
实验③:v(B)=___________________。
参考答案:
 本题解析:略 本题解析:略
本题难度:一般
5、计算题 (10分)在温度为373K时,把0.25moi NO2气体通入体积为500ml的真空密闭容器中,发生反应:2NO2(g) 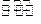 N2O4(g) .反应进行到2s时,N2O4含量为0.05mol,进行到60s时,达到该条件下反应的最大限度,此时容器中混合气体的平均相对分子质量为47.5,则: N2O4(g) .反应进行到2s时,N2O4含量为0.05mol,进行到60s时,达到该条件下反应的最大限度,此时容器中混合气体的平均相对分子质量为47.5,则:
(1)开始时2s内以c (NO2)的变化表示的反应速率是多少?
(2)达到最大限度时体系内的压强是开始的多少倍?
参考答案:(1)0.1mol/L·s?(2)0.8? (各5分)
本题解析:略
本题难度:简单
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772