微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)

已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇水会强烈水解生成H3PO3和HCl,遇O2会生成POCl3,POCl3溶于PCl3。PCl3、POCl3的熔沸点见下表:
物质
| 熔点/℃
| 沸点/℃
|
PCl3
| -112
| 75.5
|
POCl3
| 2
| 105.3
?
请回答下列问题:
(1)A装置中制氯气的离子方程式为 。?
(2)B中所装试剂是 ,E中冷水的作用是 ,F中碱石灰的作用是 。?
(3)实验时,检查装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷。通入干燥CO2的作用是 。通过控制K1、K2能除去A、B装置中的空气,具体的方法是 。?
(4)粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后,通过 (填实验操作名称),即可得到较纯净的PCl3。?
2、实验题 请你设计至少两种方法除去细小的铁颗粒中混有的细小的铝颗粒。(简要说明)
_______________________________________________
3、选择题 能够鉴定1—氯丙烷中存在氯元素的操作是
A.在1—氯丙烷中直接加入AgNO3溶液
B.将1—氯丙烷溶于水,然后加入AgNO3溶液
C.在1—氯丙烷中加入NaOH溶液,加热再用硝酸酸化,然后加入AgNO3溶液
D.在1—氯丙烷中加入乙醇,加热再用盐酸酸化,然后加入AgNO3溶液
4、填空题 工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:
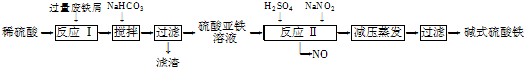
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
沉淀物
| Fe(OH)3
| Fe(OH)2
| Al(OH)3
| 开始沉淀
| 2.3
| 7.5
| 3.4
| 完全沉淀
| 3.2
| 9.7
| 4.4
?
回答下列问题:
(1)反应Ⅰ中发生的氧化还原反应的化学方程式为??????????????????????????。
(2)加入少量NaHCO3的目的是调节pH,使溶液中的________(填“Fe3+”、“Fe2+”或“Al3+”)沉淀。该工艺流程中“搅拌”的作用是______________________。
(3)反应Ⅱ的离子方程式为??????????????????????????___。在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作____?????____。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为________。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为____________________________。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为________(填字母)。
A. 氯水 B. KSCN溶液 C. NaOH溶液 D. 酸性KMnO4溶液
5、选择题 从碘的四氯化碳溶液中分离出碘、并回收四氯化碳,所采用的方法是
A.蒸发
B.蒸馏
C.过滤
D.分液
|
|