微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (11分)下图物质A~K均由a、b、c、d、e、f五种元素组成。a、b、c、d、e、f为原子序数依次增大的短周期元素;由a、b、c、d四种元素形成酸式盐A;b的最外层电子数是电子层数的2倍;由d、e元素可形成两种离子化合物,且阳离子与阴离子的个数比都为2 : 1,其中一种为X;B、C、D为常见的气体;F为白色胶状物质。(部分产物未列出)
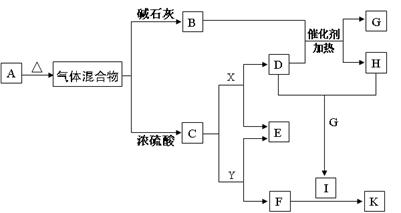
(1)物质A的化学式_______________
(2)Y的溶液呈????????性(填“酸性” 、“碱性” 或“中性”),用离子反应方程式解释原因:???????????????????
(3)将溶液K蒸干灼烧,得到的固体产物为???????,此固体产物的用途是?????????????(答出一条即可)
(4)B与H在一定条件下反应生成c单质和G,反应中氧化产物与还原产物物质的量之比为????????????
(5)常温下,向0.1mol/L的K溶液中加入Na2O2,加入Na2O2的质量与产生沉淀的质量具有如图所示关系
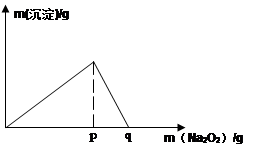
①当溶液pH=????,开始生成沉淀(已知生成沉淀的Ksp=1×10-31 )
②p点时产生沉淀与放出气体的物质的量之比为??????
③从开始加Na2O2固体至q点的整个过程中,总反应的离子方程式为????????????????????????????。
参考答案:(1) NH4HCO3(1分)
(2)碱性(1分)??
本题解析:
试题分析:b的最外层电子数是电子层数的2倍,则b可能为C 和S
和S ,但a、b、c、d、e、f为原子序数依次增大的短周期元素,则b原子序数较小只能为C。d、e元素可形成两种离子化合物,且阳离子与阴离子的个数比都为2 : 1,则d只能是O元素,e只能是Na元素,X可能为Na2O2或Na2O。a、b、c、d四种元素形成酸式盐A,则A为NH4HCO3。NH4HCO3=NH3+H2O+CO2,则C为CO2,B为NH3。X为Na2O2,D为O2,G为H2O,H为NO,I为NO2。F为白色胶状物质,则F为Al(OH)3,则Y为NaAlO2,K为Al(NO3)3。
,但a、b、c、d、e、f为原子序数依次增大的短周期元素,则b原子序数较小只能为C。d、e元素可形成两种离子化合物,且阳离子与阴离子的个数比都为2 : 1,则d只能是O元素,e只能是Na元素,X可能为Na2O2或Na2O。a、b、c、d四种元素形成酸式盐A,则A为NH4HCO3。NH4HCO3=NH3+H2O+CO2,则C为CO2,B为NH3。X为Na2O2,D为O2,G为H2O,H为NO,I为NO2。F为白色胶状物质,则F为Al(OH)3,则Y为NaAlO2,K为Al(NO3)3。
点评:关键是利用题干信息找到突破点,再依次根据推导的框图来求未知物。本题的突破点很多,比如说白色胶状物质应该是氢氧化铝,还有一些明显的信息可以直接推出未知物。
本题难度:一般
2、实验题 (6分)如图装置可以用来制取某些气体。

(1)该装置可以制备乙炔气体,圆底烧瓶中盛放的物质是????????(填化学式)。
(2)还能用该装置制备和收集的气体有(答出任意一种即可)????????。
(3)若用来制备乙烯气体,需要对装置进行改进,将分液漏斗改成温度计,温度计的水银球放置的位置是?????????,改进时还需要的玻璃仪器是????????;反应的化学方程式是??????????????????????????????????????????????????????????????。
参考答案:(1)CaC2???(2)O2或H2
(3)插入液面下
本题解析:(1)实验室制取乙炔的试剂是碳化钙和饱和食盐水。
(2)该装置属于固体和液体反应且不需要加热,同时生成的气体难溶于水,所以可以是氢气或氧气。
(3)实验室制取乙烯需要加热,控制溶液的温度170℃,所以温度计的水银球要插入溶液中。
本题难度:一般
3、填空题 现配制500mL0.5moI/L的NaOH溶液
(1)需要的仪器除用量筒、烧杯、玻璃棒外,(2)还需要的玻璃仪器有__________.
(3)用托盘天平称量氢氧化钠固体时,?(4)应在小烧杯里应称量___克氢氧化钠.
(5)配制过程主要有:溶解、_____、转移、______、加水稀释、定容、摇匀,而
(6)后转移到试剂瓶里并贴上标(7)???签。(8)若取上述溶液100mL,(9)其物质的量浓度为________(10)如果其它各项操作均正常,(11)????????????????仅有一项下列操作时,(12)对配制结果有何影响(填偏高、偏低、无影响或无法确定)?定容时俯视刻度线________.配制前容量瓶不干燥_______.定容后摇匀时有液体贱出______.
参考答案:(1)500mL的容量瓶和胶头滴管,(2)10.0 (3)冷
本题解析:略
本题难度:简单
4、实验题 实验室用下图所示实验装置制取纯净的CuCl2,完成下列问题:
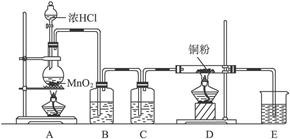
(1)实验室里,实验前检查整套装置的气密性方法是:_____________________________。
(2)装置A中发生的化学反应方程式为_____________________________。
(3)装置B的广口瓶盛__________,其作用是_____________________________________。装置C的广口瓶盛__________,其作用是___________________。装置E的烧杯中盛有,其作用是_____________________________。
(4)待充分反应后,装置D的玻璃管中剩余物呈_________色,冷却后,将制得的产物配成饱和溶液,溶液呈_________色。
参考答案:(1)按图示装置装配好,在烧杯中盛半杯水,然后在烧瓶底部稍加
本题解析:本题有一定的综合性,把氯气的实验室制法和氯气的化学性质结合起来。制纯净干燥的氯气,要除去混在氯气中的氯化氢和水蒸气。除去氯化氢气体用饱和食盐水,除去水蒸气用浓硫酸。
本题难度:简单
5、实验题 以废铁屑为原料制备FeCl3溶液,用作印刷电路铜板腐蚀剂,并对溶液B进行电解处理的实验流程如下:

(1)试剂a应选用???????(填写名称);
(2)步骤I用到的主要玻璃仪器有漏斗、???????(填写仪器名称);
(3)写出步骤Ⅱ中主要反应的化学方程式:???????;
(4)实验室制取气体E的离子方程式是???????,欲对气体E进行干燥和吸收,需选用下列装置中的???????(填写序号);
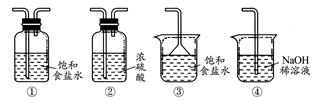
(5)如何用化学方法检验气体E????????。
参考答案:(1)稀盐酸
(2)烧杯、玻璃棒
(3)2FeC
本题解析:分析流程中的物质及其化学反应,废铁屑中加入热碱液是为了除去铁屑表面的油污,与Fe反应生成Fe2+的试剂只能选用HCl,才能由A经Cl2氧化后生成FeCl3,若换成H2SO4、HNO3等其他酸,则引入SO42-、NO3-等杂质。过滤需用的玻璃仪器有:漏斗、烧杯、玻璃棒;2FeCl3+Cu=2FeCl2+CuCl2,则B中含有FeCl2、CuCl2、FeCl3等溶质,将其电解时,根据阳离子放电顺序先析出Cu,阳极生成Cl2,但是由于氧化性Fe3+>Cu2+,则Fe3+一定放电成Fe2+后才有Cu单质析出;Cl2的实验室制法为MnO2与浓盐酸反应,则Cl2中混有HCl、H2O等杂质,干燥Cl2用②,吸收Cl2用④;Cl2的检验方法是用湿润的淀粉?KI试纸。
本题难度:一般