微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某学生配制一定物质的量浓度的氢氧化钠溶液后,经测定发现溶液浓度偏低。该学生找出以下原因,其中不会使溶液浓度偏低的是(??)
A.没有用蒸馏水洗烧杯2—3次,并将洗液移入容量瓶中
B.容量瓶刚用蒸馏水洗净,没有烘干
C.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切
D.定容时仰视刻度线
参考答案:B
本题解析:
试题分析:根据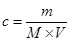 ,A项没有洗烧杯,导致溶质损失,浓度偏低;B项容量瓶没有烘干不影响溶质的浓度变化;C项加入的水过多,溶液浓度偏低;D项定容时仰视刻度线,溶液体积偏大,溶液浓度偏低。
,A项没有洗烧杯,导致溶质损失,浓度偏低;B项容量瓶没有烘干不影响溶质的浓度变化;C项加入的水过多,溶液浓度偏低;D项定容时仰视刻度线,溶液体积偏大,溶液浓度偏低。
点评:误差分析要考虑整个配制过程出现的错误操作,难度中等。
本题难度:简单
2、实验题 用浓度为0.10 mol/L的KMnO4(H+)溶液滴定未知浓度的H2C2O4(弱酸)溶液,其实验步骤如下:
I、滴定前的准备:
?①?→ 用蒸馏水清洗 → 用待装溶液润洗 → 装液→ ??②??→ 调节液面在零刻度或零刻度以下 → 记录初始读数
II、滴定:
分别取20.00 mL 草酸溶液于4个洁净的锥形瓶中,滴加几滴MnSO4溶液,然后用标准的KMnO4(H+)溶液进行滴定至终点,记录最终读数。数据如下:
测定次序
| 第一次
| 第二次
| 第三次
| 第四次
|
初始读数(mL)
| 0.40
| 0.10
| 0.90
| 0.00
|
最终读数(mL)
| 25.05
| 20.10
| 21.00
| 19.90
|
V标(mL)
| 24.65
| 20.00
| 20.10
| 19.90
III、实验数据处理:略
请回答下列问题:
(1)将步骤I中的操作补充完整:
①__________________________???
②__________________________
(2)KMnO4(H+)溶液应装入________式滴定管进行滴定;
(3)向锥形瓶中滴加MnSO4溶液的作用是_____________________________________;判断已达滴定终点的现象是:_____________________________________;
(4)该滴定反应的离子方程式为:__________________________________________;
(5)实验测得草酸溶液的浓度为_____________mol/L;
(6)下列操作会引起实验结果偏高的是_____________
A.向锥形瓶中加入了较多 MnSO4溶液
B.滴定振摇时,锥形瓶中溶液溅出
C.滴定时,锥形瓶内壁附有紫红色溶液,未用蒸馏水冲洗
D.滴定结束时,仰视读数
参考答案:(13分)
(1)①查漏;?②排除滴定管尖嘴处的气泡?
本题解析:
试题分析:(1)滴定实验开始就检查滴定管是否合格,为检漏操作,待装液以后要排气泡。(2)KMnO4(H+)溶液具有很强的氧化性,装到酸式滴定管中。(3)MnSO4溶液做为催化剂加快反应速率。(6)A项:无影响;B项:会偏低。
点评:本题考查的是滴定实验操作,学生要注意滴定实验中操作的顺序以及规范操作,且能对有误差能进行分析出来。
本题难度:一般
3、填空题 (14分)孔雀石的主要成分为Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuCl2·3H2O及CaCO3的步骤如下:
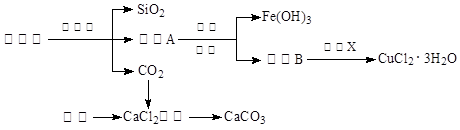
为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如下:
物质
| pH (开始沉淀)
| pH(完全沉淀)
| Fe(OH)3
| 1.9
| 3.2
| Fe(OH)2
| 7.0
| 9.0
| Cu(OH)2
| 4.7
| 6.7
⑴“除杂”时先通入足量Cl2将Fe2+氧化成Fe3+,再加入CuO固体调节溶液的pH至???(填写范围)。检验Fe(OH)3是否沉淀完全的实验方案是??。
⑵操作X包括???、???、过滤和洗涤等。CuCl2·3H2O加热灼烧的最终产物的化学式是???。
⑶某种胃药片的治酸剂为CaCO3,该药片中CaCO3质量分数的测定步骤如下:
a.配制0.1mol·L-1的HCl溶液和0.1mol·L-1的NaOH溶液各250mL。
b.取0.1g磨碎后的胃药于锥形瓶中。
c.向锥形瓶内加入25.00mL 0.1 mol·L-1的HCl溶液。
d.以酚酞为指示剂,用0.1mol·L-1的NaOH溶液滴定,至达到滴定终点。
e.重复bcd三步的操作2次。
①操作c中量取盐酸体积的仪器是???。
②若洗涤后的碱式滴定管未用NaOH溶液润洗,则所测CaCO3的质量分数将???(选填“偏大”、“偏小”或“无影响”)。
③若滴定中NaOH溶液的平均用量为15.00mL,则胃药中碳酸钙的质量分数为???。
参考答案:⑴3.2-4.7??取少量上层清液,滴加KSCN溶液,若不出
本题解析:(1)因为要沉淀氢氧化铁,而不能沉淀氢氧化铜,所以根据物质沉淀的pH数据可知pH不能超过4.7,但要大于3.2。若沉淀不完全,则溶液中一定含有铁离子,所以可利用KSCN来检验。
(2)要从溶液中析出氯化铜晶体,需要经过蒸发浓缩、冷却结晶。氯化铜在溶液中存在电离平衡,而加热促进水解,所以最终得到的是氢氧化铜,灼烧得到氧化铜。
(3)要量取25.00mL盐酸需要算式滴定管,若碱式滴定管未用NaOH溶液润洗,则相当于稀释了氢氧化钠,则消耗的氢氧化钠溶液体积偏大,因此最终测CaCO3的质量分数将偏小。消耗氢氧化钠的物质的量是0.015L×0.1mol·L-1=0.0015mol,需要的盐酸是0.0015mol,因此与碳酸钙反应的盐酸是0.0025mol-0.0015mol=0.001mol,所以碳酸钙的物质的量是0.0005mol,质量是0.05g,所以胃药中碳酸钙的质量分数为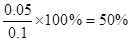 。 。
本题难度:一般
4、选择题 除去CO中少量的CO2,选用的试剂和装置均正确的是( )
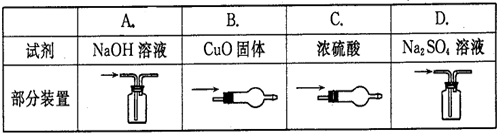
A.A
B.B
C.C
D.D
参考答案:A、二氧化碳是酸性气体,能和碱液反应,一氧化碳和碱不反应,所
本题解析:
本题难度:简单
5、实验题 实验室用下图所示实验装置制取纯净的CuCl2,完成下列问题:
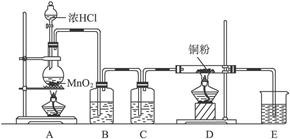
(1)实验室里,实验前检查整套装置的气密性方法是:_____________________________。
(2)装置A中发生的化学反应方程式为_____________________________。
(3)装置B的广口瓶盛__________,其作用是_____________________________________。装置C的广口瓶盛__________,其作用是___________________。装置E的烧杯中盛有,其作用是_____________________________。
(4)待充分反应后,装置D的玻璃管中剩余物呈_________色,冷却后,将制得的产物配成饱和溶液,溶液呈_________色。
参考答案:(1)按图示装置装配好,在烧杯中盛半杯水,然后在烧瓶底部稍加
本题解析:本题有一定的综合性,把氯气的实验室制法和氯气的化学性质结合起来。制纯净干燥的氯气,要除去混在氯气中的氯化氢和水蒸气。除去氯化氢气体用饱和食盐水,除去水蒸气用浓硫酸。
本题难度:简单
|
|