微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 1000℃时,在恒容密封容器中发生下列反应:Na2SO4(s)+4H2(g)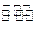 Na2S(s)+4H2O(g)。
Na2S(s)+4H2O(g)。
(1)该温度下,在2L盛有1.42 g Na2SO4的密闭容器中通入H2气体,5分钟后测得固体质量为1.10 g。
则5分钟内H2的平均反应速率为?????????。
(2)能说明该反应已达到平衡状态的是____(填序号)。
a.容器内压强保持不变???????????????????????????????????? b.容器内气体密度保持不变
c.c(H2)=c(H2O)??? d.v正(H2)=v逆(H2O)
(3)向该容器中分别加入以下物质,对平衡的影响如何?,(填“正向移动”,“逆向移动”或“不发生移动”)
①加入少量Na2SO4固体,则平衡:????????②加入少量灼热的碳粉,则平衡:__???
(4)若将反应后的物质溶于水,用有关离子方程式说明上述反应产物水溶液的酸碱性___??_,欲使该溶液中S2-浓度增大,平衡逆向移动,可加入的物质是????????。
参考答案:
 本题解析:略
本题解析:略
本题难度:一般
2、填空题 将1molCO和1molH2O充入某固定容积的反应器中,在某条件下达到平衡:
CO+H2O(g)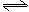 CO2+H2,此时有2/3的CO转化为CO2。
CO2+H2,此时有2/3的CO转化为CO2。
(1)该平衡混合物中CO2的体积分数为???????????
(2)若容器体积为1L,到达平衡所需时间为2分钟,则H2的平均反应速率为?????????
(3)若在相同条件下,向容器中充入1molCO2、1molH2和1molH2O,则达到平衡时与⑴中平衡相比较,平衡应向????????(填“正反应方向”、“逆反应方向”或“不”)移动,此时平衡混合物中CO2的体积分数可能是下列各值中的??????
A.22.2%
B.27.55%
C.33.3%
D.36.8%
(4)结合(3)中计算结果分析若平衡向正方向移动时,则下列说法中正确的是(???)
①生成物的产量一定增加;??????????????②生成物的体积分数一定增加;
③反应物的转化率一定增大; ????????????④反应物的浓度一定降低;
⑤正反应速率一定大于逆反应速率;???????⑥一定使用了催化剂.
参考答案:(1)33.3%;(2分)
(2) 本题解析:略
本题解析:略
本题难度:一般
3、填空题 在容积为2.0 L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如下图,据图回答下列问题:
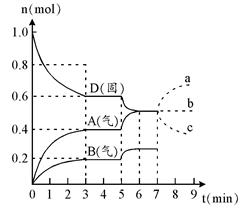
(1)从反应开始到第一次达到平衡时,A物质的平均反应速率为??????????。
(2)根据右图写出该反应的化学方程式??????????。
(3)第5分钟时,升高温度,A、B、D的物质的量变化如右图,则该反应是??????(填“放热”或“吸热”)反应。若在第7分钟时增加D的物质的量,A的物质的量变化正确的是_____(用图中a~c的编号回答)
(4)某同学在学习了“化学反应速率和化学平衡”专题后,发表如下观点,你认为错误的是??????????。
a.化学反应速率理论是研究怎样在一定时间内快出产品
b.化学反应速率理论是研究怎样提高原料转化率
c.化学平衡理论是研究怎样使用有限原料多出产品
d.正确利用化学反应速率和化学平衡理论都可以提高化工生产的综合效益
参考答案:(1)0.067mol/(L·min)?(2分,单位不写扣1
本题解析:略
本题难度:简单
4、填空题 1200℃时可用反应 2BBr3(g)+ 3H2(g)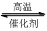 2B(s) + 6HBr(g) 来制取晶体硼。完成下列填空:
2B(s) + 6HBr(g) 来制取晶体硼。完成下列填空:
(1)下列说法能说明该反应达到平衡的是______(选填序号,下同)。
a. v正(BBr3)= 3v逆(HBr)????????????? b. 2c(H2) = c(HBr)
c.密闭容器内压强不再变化?????????? d. 容器内气体平均摩尔质量不再变化
(2)若密闭容器体积不变,升高温度,晶体硼的质量增加,下列说法正确的是_________。
a. 在平衡移动时正反应速率先增大后减小
b. 在平衡移动时逆反应速率始终增大
c. 正反应为放热反应
d. 达到新平衡后反应物不再转化为生成物
(3)若上述反应在10L的密闭容器内反应,5min后,气体总质量减少1.1 g,则该时间段内氢气的平均反应速率为__________________。
(4)往容器中充入0.2 mol BBr3和一定量H2,充分反应达到平衡后,混合气体中HBr百分含量与起始通入H2的物质的量有如图关系。在a、b、c三点中,H2 的转化率最高的是______(选填字母)。b点达到平衡后,再充入H2使平衡到达c点,此过程中平衡移动的方向为__________(填“正向”、“逆向”或“不移动”)。
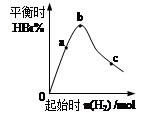
参考答案:(本题共8分)(1) cd(2分);(2)ab(2分);
本题解析:
试题分析:(1)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。a.v正(BBr3)=3v逆(HBr),说明二者的反应速率方向相反,但不能满足反应速率之比是相应的化学计量数之比,应该是3v正(BBr3)=v逆(HBr)时可以说明,a不正确;b.2c(H2)=c(HBr)满足反应速 率之比是相应的化学计量数之比,但不能确定反应的方向,因此不一定能说明,b不正确;c.反应是体积增大的可逆反应,因此当密闭容器内压强不再变化时可以说明反应达到平衡状态,c正确;d.混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量和物质的量都是变化的,所以容器内气体平均摩尔质量不再变化时可以说明达到平衡状态,d正确,答案选cd。
(2)若密闭容器体积不变,升高温度,晶体硼的质量增加,这说明平衡向正反应方向移动,因此正方应是吸热反应。a.升高温度,平衡向正反应方向移动,所以在平衡移动时正反应速率先增大后减小,a正确;b. 升高温度,平衡向正反应方向移动,所以在平衡移动时逆反应速率始终增大,b正确;c.正反应为吸热反应,c不正确;d.达到新平衡后正逆反应速率相等,但不为0,所以反应物不再转化为生成物是错误的,d不正确,答案选ab。
(3)根据方程式可知:2BBr3(g)+ 3H2(g) 2B(s) + 6HBr(g)?△m↓
2B(s) + 6HBr(g)?△m↓
3mol??????????????????????????? 22g
0.15mol????????????????????????? 1.1g
因此消耗氢气的浓度是0.15mol÷10L=0.015mol/L
所以氢气的反应速率=0.015mol/L÷5min=0.003mol/(L·min)
(4)在BBr3的物质的量固定的条件下,氢气的量越多,BBr3的转化率越高而氢气的转化率越低,因此根据图像可知,氢气转化率最高的是a点;b点达到平衡后,再充入H2使平衡到达c点,增大反应物浓度平衡向正反应方向越低,因此在此过程中平衡移动的方向为正向。
本题难度:一般
5、实验题 (18分)铵盐在工农业生产中有着重要的用途,请根据要求完成下列各题。
Ⅰ.某化学兴趣小组欲从下列装置中选取必要的装置制取(NH4)2SO4溶液。
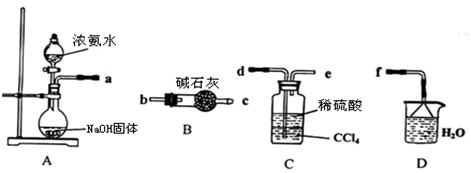
(1)仪器连接的顺序(用接口序号字母表示)是:a????????????????
(2)试从电离平衡角度分析该实验装置A中能产生氨气的原因:?????????????????????????
??????????????????????????????????????????????????????。
(3)将装置C中两种液体分离开的操作名称是???????????????。
(4)(NH4)2SO4“低毒,有刺激性,有吸湿性、吸湿后固结成块”。储存应注意????????????????。
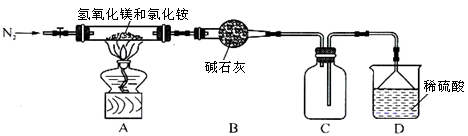
Ⅱ.为提高氯化铵的经济价值,我国化学家设计了利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁[Mg(OH)Cl]的工艺。某同学根据该原理设计的实验装置如图:
 ?
?
请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为??????????????????????????。
(2)反应过程中持续通入N2的作用有两点:一是使反应产生的氨气完全导出并被稀硫酸充分吸收,
二是?????????????????????????????????????????????。
(3)由MgCl2溶液蒸发得到MgCl2·6H2O晶体,蒸发的目的是_________。
a.得到热饱和溶液??????b.析出晶体
(4)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。
①若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是:???????????????????????????
????????????????????????????????????????????。
②由MgCl2·6H2O制备无水MgCl2的操作在?????????????氛围中进行,若在空气中加热,则会生成Mg(OH)Cl。
参考答案:(18分)
Ⅰ(1)d e f? (2分)
(2
本题解析:
试题分析:Ⅰ(1)制取的氨气与硫酸反应生成硫酸铵,剩余的氨气用水吸收,故连接顺序为a→d→e→f。
(2)氨水中存在电离平衡: NH3+H2O  ?NH4++OH—,与NaOH混合后,NaOH电离出OH-,促使氨水电离平衡向左移动,有利氨气逸出。
?NH4++OH—,与NaOH混合后,NaOH电离出OH-,促使氨水电离平衡向左移动,有利氨气逸出。
(3)分离互不相溶的液体的方法是:分液。
(4)因为(NH4)2SO4“低毒,有刺激性,有吸湿性、吸湿后固结成块”,应防止水分进入,所以储存应注意密封、阴凉、通风。
Ⅱ(1)根据题目所给信息,反应物为Mg(OH)2和NH4Cl,生成物为MgOHCl、NH3和H2O,所以化学方程式为:Mg(OH)2+NH4Cl MgOHCl+NH3↑+H2O。
MgOHCl+NH3↑+H2O。
(2)防止装置C中的AlCl3溶液倒吸入装置B
(3)由MgCl2溶液得到MgCl2·6H2O晶体的方法为蒸发浓缩、降温结晶,所以蒸发的目的是:得到热饱和溶液,故a项正确。
(4)①Na元素用焰色反应进行鉴别,所以操作方法是:用铂丝蘸取少量固体,置于酒精灯火焰上灼烧,若无黄色火焰产生,则证明所得无水氯化镁晶体中不含氯化钠。
②因为MgCl2为强酸弱碱盐,Mg2+发生水解反应,在HCl(气流)中可以抑制MgCl2的水解,所以由MgCl2·6H2O制备无水MgCl2的操作在HCl氛围中进行。
本题难度:一般