微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 关于晶体的下列说法正确的是( )
A.化学键都具有饱和性和方向性
B.晶体中只要有阴离子,就一定有阳离子
C.氢键具有方向性和饱和性,也属于一种化学键
D.金属键由于无法描述其键长、键角,故不属于化学键
参考答案:B
本题解析:
试题分析:A、共价键具有饱和性和方向性,A不正确;B、晶体中只要有阴离子,就一定有阳离子,B正确;C、氢键不是化学键,C不正确;D、金属键属于化学键,D不正确,答案选B。
本题难度:一般
2、填空题 (10分)有A、B、C、D、E、F六种元素,已知:
①它们位于三个不同短周期,核电荷数依次增大??②B与F同主族。
③B、C分别都能与D按原子个数比1∶1或1∶2形成化合物。
④A、E分别都能与D按原子个数比1∶1或2∶1形成化合物。
⑤E元素的电离能数据如下 (kJ·mol-1):
I1
| I2
| I3
| I4
| …
|
496
| 4562
| 6912
| 9540
| …
?(1)写出只含有A、B、D、E四种元素的两种无水盐的化学式__________、__________。
(2)B2A2分子中存在______个σ键,______个π键。
(3)人们通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于计算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
化学键
| F—D
| F—F
| B—B
| F—B
| C—D
| D—D
| 键能/kJ·mol-1
| 460
| 176
| 347.7
| 347
| 745
| 497.3
试计算1 mol F单质晶体燃烧时的反应热ΔH=_____????????????(要写单位)。
参考答案:(1)NaHCO3 CH3COONa(或其他有机酸的盐)??
本题解析:根据E元素的电离能可判断,E是第IA。又因为的E的原子序数仅小于F的,所以E是钠元素。则D是氧元素,所以A是氢元素,B是碳元素,C是氮元素,F是硅元素。
(1)有H、C、O、Na形成的无水盐是NaHCO3和CH3COONa(或其他有机酸的盐)。
(2)乙炔分子中还有碳碳三键,因为单键全部是σ键,三键是由1个σ键和2个π键构成的。是由乙炔分子中含有3个σ键和2个π键。
(3)硅燃烧的化学方程式为Si+O2 本题难度:一般 本题难度:一般
3、选择题 已知断开1 mol H2中的化学键需要吸收436kJ的能量,断开1 mol Cl2中的化学键需要吸收243kJ的能量,而形成1mol HCl分子中的化学要释放431kJ的能量,则1mol氢气与1mol氯气反应时能量变化为
A.吸收183kJ
B.吸收366kJ
C.放出183kJ
D.放出366kJ
参考答案:C
本题解析:
试题分析:根据反应热等于反应物的总键能-生成物的总键来解答;H2(g)+Cl2(g)=2HCl(g)的反应热=生成物的键能减反应物的键能=436kJ?mol-1+243kJ?mol-1-2×431 kJ?mol-1=-183kJ?mol-1,故1mol氢气与1mol氯气反应时放出热量为183KJ,故选:C。
考点:考查反应热的计算
本题难度:一般
4、选择题 下列物质中,既含有共价键又含有离子键的是
A.NaOH
B.NaCl
C.Na2O
D.HCl
参考答案:A
本题解析:BC中只有离子键,D中只有共价键。
本题难度:一般
5、填空题 汽车尾气净化中的一个反应如下:2NO(g)+2CO(g) N2(g)+2CO2(g) N2(g)+2CO2(g)
请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g);△H= +180.5kJ/mol
C(s)+O2(g) =CO2(g);△H=" -393.5" kJ/mol
2C(s)+O2(g)=2CO(g);△H= -221kJ/mol
则2NO(g)+2CO(g) N2(g) +2CO2(g)的△H=___________。 N2(g) +2CO2(g)的△H=___________。
(2)在一定温度下,在一体积为V升的密闭容器中充入一定量的NO和CO2在t1时刻达到平衡状态,此时n(CO)="a" mol,n(NO)="2a" mol,n(N2)="b" mol,且N2占平衡总体积的1/4。
①则该反应的平衡常数K=_______???????____。(用只含a、V的式子表示)
②判断该反应达到平衡的标志是____???????_____
A.v生成(CO2)=v消耗(CO)??????????????????B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变????? D.NO、CO、N2、CO2的浓度均不再变化
③在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态。请在右图中补充画出从t2到t4时刻正反应速率随时间的变化曲线:

(3)如果要净化汽车尾气同时提高该反应的速率和NO的转化率,采取的措施是___________
A.降低温度???????????????????????????B.增大压强同时加催化剂
C.升高温度同时充入N2????????????????D.及时将CO2和N2从反应体系中移走
(4)为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气净化装置。净化装置里装有含Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如下图所示。
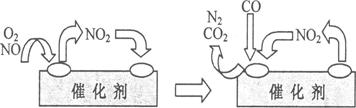
①写出此变化中的总化学反应方程式:_________??????????_______________________________。
②有人提出,可以设计反应2CO(g)=2C(s)+O2(g)来消除CO的污染。请你判断是否可行并说出理由:_____________________________________________________________。
参考答案:(14分)??? (1) △H="-746.5" kJ/mo
本题解析:
试题分析:(1)根据盖斯定律可知,②×2-①-③即得到2NO(g)+2CO(g) N2(g) +2CO2(g),所以该反应的△H=-393.5 kJ/mol×2-180.5kJ/mol+221kJ/mol=-746.5 kJ/mol。 N2(g) +2CO2(g),所以该反应的△H=-393.5 kJ/mol×2-180.5kJ/mol+221kJ/mol=-746.5 kJ/mol。
(2)①达到平衡状态,此时n(CO)="a" mol,n(NO)
本题难度:一般
|
|