微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 CO不仅是家用煤气的主要成分,也是重要的化工原料.美国近年来报导了一种低温低压催化工艺,把某些简单的有机物经“羰化”反应后可以最后产生一类具有优良性能的装饰性高分子涂料、粘合剂等.如图所示:

图中G(RCOOR*)的一种同分异构体是E的相邻同系物;而H的一种同分异构体则是F的相邻同系物.已知D由CO和H2按物质的理之比为1:2完全反应而成,其氧化产物可发生银镜反应:H是含有4个碳原子的化合物.试写出:
(1)结构简式:E______、G______.
(2)G的两个同类别同分异构体的结构简式______、______.
(3)G的同分异构体中核磁共振氢谱只有一种的结构简式______.
(4)反应类型:X______Y______.
(5)写出下列转化的化学方程式:
①A+CO+H2O
E;?②F+DH.
①______.
②______.
参考答案:电石与水反应生成A,A为CH≡CH,D由CO和H2按物质的量之比为1:2完全反应而成,D的最简式为CH4O,最简式即为分子式,其氧化产物可发生银镜反应,故D为CH3OH,D与E反应生成G,G属于酯,故E为羧酸,G能与氢气发生加成反应生成H,且H含有4个碳原子,故G中含有不饱和键,含有4个C原子,故E含有3个C原子,结合CH≡CH、CO、H2O生成E,故E为CH2=CHCOOH,G为CH2=CHCOOCH3,H为CH3CH2COOCH3,F与D(CH3OH)反应生成H,故F含有-COOH,且含有三个C原子,故F为CH3CH2COOH,酒精在浓硫酸、加热170℃条件下发生消去反应生成CH2=CH2,故B为CH2=CH2,CO、H2O生成CH3CH2COOH,G通过加聚反应生成高分子涂料粘胶剂.
(1)通过以上分析知,E和G的结构简式分别为:E:CH2=CHCOOH:G:CH2=CHCOOCH3,
故答案为:CH2=CHCOOH;CH2=CHCOOCH3;
(2)G的结构简式为:CH2=CHCOOCH3,G的同类别的同分异构体为:HCOOCH2CH=CH2、CH3COOCH=CH2,
故答案为:HCOOCH2CH=CH2;CH3COOCH=CH2;
(3)G的同分异构体中核磁共振氢谱只有一种,说明只有一种H原子,所以它的结构简式为CH3COCOCH3,
故答案为:CH3COCOCH3;
(4)G和氢气发生加成反应生成H,乙醇发生消去反应生成乙烯,所以X和Y分别发生的反应是加成反应和消去反应,故答案为:加成反应;消去反应;
(5)两个反应方程式分别为:①HC≡CH+CO+H2O催化剂
本题解析:
本题难度:一般
2、选择题 下列有关问题,与盐的水解有关的是?(?)
①NH4Cl与ZnCl2溶液可做焊接金属中的除锈剂
②用NaHCO3与Al2(SO4)3两种溶液可做泡沫灭火剂
③草木灰与铵态氮肥不能混合施用
④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞
⑤加热蒸干AlCl3溶液得到Al(OH)3固体
⑥用热的Na2CO3溶液去污
⑦使用明矾净水
⑧贮存FeCl3溶液滴加几滴盐酸
A.①②③⑤
B.②③④⑥⑧
C.①④⑤⑦⑧
D.全部
参考答案:D
本题解析:NH4Cl与ZnCl2均水解显酸性,所以可做焊接金属中的除锈剂。NaHCO3水解显碱性,Al2(SO4)3水解显酸性,水解相互促进,生成氢氧化铝和CO2。草木灰水解显碱性,铵态氮肥水解显酸性,混合施用会降低肥效。碳酸钠水解显碱性,容易在瓶口周围产生硅酸钠,而不易打开瓶塞。铝离子水解,生成氢氧化铝和氯化氢,水解吸热,加热促进水解。同时氯化氢的挥发,进一步促进水解,所以最终得到的是氢氧化铝。碱性越强,去污能力就越强。明矾溶于水,铝离子水解,生成氢氧化铝胶体,悬浮悬浮物,从而净水。FeCl3水解显酸性,加入盐酸,抑制水解。所以答案是D。
本题难度:一般
3、填空题 (16分)I.合成氨的原料气H2可通过反应CO(g)+H2O(g)  CO2 (g) +H2(g) 获取。
CO2 (g) +H2(g) 获取。
(1)T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为 ,该温度下反应的平衡常数K值为 。
(2)保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入固定容器中进行反应,下列描述能够说明体系处于平衡状态的是 (填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n (CO) : n (H2O) : n (CO2) : n (H2) = 1 : 16 : 6 : 6
II.(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧实验中相关的反应有:
①4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H1
②4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H2
③4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H3
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1= 。
(2)美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置用铂作为电极、加入碱性电解质溶液,其电池反应为4NH3+3O2=2N2+6H2O
①写出该燃料电池的正极反应式 。
②若用该燃料电池产生的电能在铁皮上镀锌(制白铁皮),某铁皮上现需要镀上9.75g锌,理论上至少需要消耗标准状况的氨气 L。
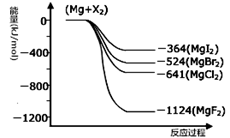
III.(1)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。由图可知Mg与卤素单质的反应均为 (填“放热”或“吸热”)反应。
(2)金属Mg与CH3Cl在一定条件下反应可生成CH3MgCl,CH3MgCl是一种重要的有机合成试剂,易与水发生水解反应并有无色无味气体和沉淀生成。写出CH3MgCl水解的化学方程式 。
参考答案:(16分)
I.(1) 60 %(2分) 2.25(2分)
(2) c、d(2分)
II.(1)
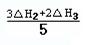 (2分)
(2分)
(2)①O2 + 4e-+ 2H2O  4OH- (2分) ② 2.24 (2分)
4OH- (2分) ② 2.24 (2分)
III.(1)放热 (2分)
(2)2CH3MgCl+H2O=2CH4↑+Mg(OH)2↓+MgCl2或CH3MgCl+H2O=CH4↑+Mg(OH)Cl↓(2分)
本题解析:I.(1)设平衡时CO的浓度减少xmol/L,则
CO(g)+H2O(g)  CO2 (g) +H2(g)
CO2 (g) +H2(g)
开始(mol/L)1/5=0.2 1/5=0.2
转化(mol/L)x x x x
平衡(mol/L)0.2-x 0.2-x x x
根据题意,CO的浓度为0.08 mol·L-1,则0.2-x=0.08,x=0.12,所以CO的转化率是0.12/0.2×100%=60%;
平衡常数K= c(CO2)·c(H2)/c(CO)·c(H2O)=x2/(0.2-x)2=2.25;
(2)a.因为该反应是气体的物质的量不变的可逆反应,则容器内压强始终不随时间改变,不能判断平衡状态,错误;b.因为容器的体积不变,则混合气体的密度始终不随时间改变,不能判断平衡状态,错误; c.单位时间内生成a mol CO2的同时消耗a mol H2,符合正逆反应速率相等,是平衡状态,正确;d.混合气中n (CO) : n (H2O) : n (CO2) : n (H2) = 1 : 16 : 6 : 6时,Qc= c(CO2)·c(H2)/c(CO)·c(H2O)= 6×6/1×16=2.25=K,所以是平衡状态,答案选cd;
II.(1)①中无NO气体,根据盖斯定律,将②×3+③×2 消去NO可得5×①,所以①中的△H1=(3△H2+2△H3)/5;
(2)①根据4NH3+3O2=2N2+6H2O,可知正极是氧气发生还原反应,生成氢氧根离子,所以正极的电极反应式为O2 + 4e-+ 2H2O  4OH-;
4OH-;
②9.75gZn的物质的量是9.75g/65g/mol=0.15mol,则失去电子的物质的量是0.15mol×2=0.30mol,根据得失电子守恒,则氧气得到电子的物质的量是0.30mol,则需要氧气的体积是0.30mol/4×22.4L/mol=1.68L,所以氨气的体积是1.68L×4/3=2.24L.
III.(1)由图可知,反应物的总能量大于生成物的总能量,所以反应为放热反应;
(2)CH3MgCl易与水发生水解反应并有无色无味气体和沉淀生成,该沉淀为氢氧化镁沉淀,根据元素守恒,则该气体中含C元素,为甲烷气体,同时还有氯化镁生成,则反应的化学方程式为2CH3MgCl+H2O=2CH4↑+Mg(OH)2↓+MgCl2。
考点:考查化学平衡的判断、计算,电化学反应原理的应用,化学方程式的判断与书写
本题难度:困难
4、选择题 下列式子中,属于水解反应的是( )
A.H2O+H2O?H3O++OH-
B.CO32-+H2O?HCO3-+OH-
C.NH3+H2O?NH3?H2O
D.HCO3-+OH-?H2O+CO32-
参考答案:B
本题解析:
本题难度:简单
5、选择题 下列溶液中各微粒的浓度关系不正确的是
A.0.1 mol/LCH3COOH溶液中:c(CH3COO-)+ c(CH3COOH)=0.1mol/L
B.CH3COONa溶液中:c(Na+)> c(CH3COO-)> c(OH-)> c(H+)
C.Na2S溶液中:2 c(Na+)= c(S2-) + c(HS-)+ c(H2S)
D.NaHCO3溶液中: c(OH-) = c(H+) + c(H2CO3)-c(CO32-)