微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 资料显示不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。为了验证这一事实,某同学拟用下图装置进行实验(实验时压强为10lkPa,温度为0℃)。
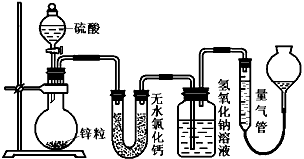
(1)若在烧瓶中放入1.30g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是
__________(选填:200,400,500)mL。
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重l.28g ,则圆底烧瓶中发生反应的化学方程式为:
________________________。
(3)若烧瓶中投入ag锌且完全反应,氢氧化钠洗气瓶增重b g.量气 瓶中收集到VmL气体,则有:
ag/65g·mol-1=bg/64g·mol-1+V mL / 22400 mL·mol-1,依据的原理是____________________________。
(4)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中,n(H2)/n(SO2)=_______________(用含字母的代数式表示)。
(5) 反应结束后,为了准确地测量气体体积,量气管在读数时应注意:___________________、
_________________、__________________。
参考答案:(1)500
(2)Zn+2H2SO4(浓)==ZnSO4+SO2+2H2O
(3)得失电子守恒
(4)(64cV-2m)/m
(5)冷却至原温度;漏斗中和量气管中液面相平;视线与凹液面的最低处相水平。
本题解析:
本题难度:困难
2、实验题 ( 12分 ) 如图所示的装置用于制备1,2 -二溴乙烷 ( 广口瓶中的NaOH溶液是为了吸收副反应产生的SO2等 ) ,请回答下列问题:
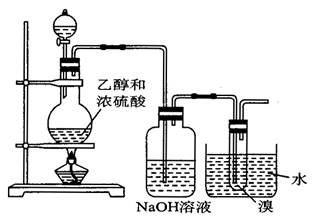
( 1 ) 加热混合物至170 ℃ 左右是为了 ____________________ 。
( 2 ) 广口瓶中NaOH溶液过量,写出吸收SO2反应的化学方程式 ___________________ 。
( 3 ) 使用水作冷却剂是为了什么?
( 4 ) 烧瓶中的混合液加热时先变棕色后变黑色是由于 _________________________ 。
( 5 ) 烧瓶中放些白瓷片,其作用是什么?
( 6 ) 生成的1,2 -二溴乙烷通常混有过量的溴,为洗去溴最好用 ______________ 。
参考答案:( 1 ) 制乙烯
? ( 2 ) SO2 + 2NaOH══Na2SO3 + H2O
? ( 3 ) 防止溴挥发
? ( 4 ) 浓H2SO4使部分乙醇氧化为碳
? ( 5 ) 防止暴沸
? ( 6 ) NaOH溶液
本题解析:该题是对实验室制乙烯的考查,原理:CH3CH2OH 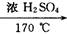 ?CH2═CH2↑ + H2O,存在的副反应有①浓H2SO4使乙醇脱水碳化,并发生2H2SO4 ( 浓 ) + C══2SO2↑ + CO2↑ + 2H2O反应,②CH3CH2OH + HO—CH2CH3
?CH2═CH2↑ + H2O,存在的副反应有①浓H2SO4使乙醇脱水碳化,并发生2H2SO4 ( 浓 ) + C══2SO2↑ + CO2↑ + 2H2O反应,②CH3CH2OH + HO—CH2CH3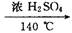 CH3CH2—O—CH2CH3 ( 乙醚 ) + H2O,所以必须控制温度在170 ℃,该题还考查了乙烯性质的验证:CH2═CH2
CH3CH2—O—CH2CH3 ( 乙醚 ) + H2O,所以必须控制温度在170 ℃,该题还考查了乙烯性质的验证:CH2═CH2 
本题难度:简单
3、简答题 图为实验室制取纯净、干燥的Cl2,并进行检验Cl2性质实验的装置.其中E瓶中放有干燥红色布条;F中为铜网,F右端出气管口附近放有脱脂棉.
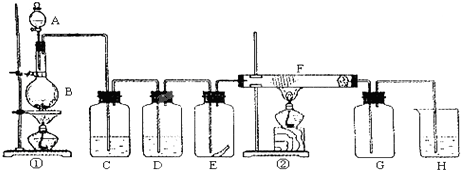
试回答:
(1)A试剂为______,B试剂为______,化学方程式为______;
(2)C试剂为______;D试剂作用为______;
(3)E中干燥红色布条______(填“褪色”或“不褪色”);
(4)F管中现象______;
(5)H中化学方程式为______.
参考答案:根据题中所给出的信息可知本实验是室制取纯净、干燥的Cl2,并进行检验Cl2性质实验.
(1)依据课本所学制备氯气用的是浓盐酸和固体MnO2的加热反应.所以A为浓盐酸,B为MnO2,反应的化学方程式为:MnO2+4HCl-?△?.?MnCl2+Cl2↑+2H2O,
故答案为:浓盐酸;MnO2;MnO2+4HCl-?△?.?MnCl2+Cl2↑+2H2O;
(2)由①中生成氯气,氯气通到C中出去挥发出的HCl气体,除去HCl气体有饱和食盐水,因此C为饱和食盐水;氯气从C中通入到D中进行干燥出去氯气的水蒸气,D中是浓硫酸,
故答案为:饱和食盐水;吸水氯气中的水蒸气;
(3)氯气从D中出来后是干燥的氯气,通到E中,干燥的氯气不能漂白,因此E中的干燥布条不褪色,故答案为:不褪色;
(4)已知F中是铜网,在加热的条件下,氯气与Cu发生反应,生成棕黄色的烟.脱脂棉的作用是为了防止防止CuCl2固体小颗粒被气体鼓入导管中,堵塞导管,影响氯气的收集,
故答案为:棕黄色的烟;
(5)氯气是有毒气体,所以H中是吸收多余气体的NaOH溶液,反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O.
本题解析:
本题难度:一般
4、选择题 用4种溶液进行实验,下表中“操作及现象”与“溶液”对应关系正确的是( )
| 选项 | 操作及现象 | 溶液
A
通入CO2,溶液变浑浊,继续通入CO2至过量,沉淀不消失.
饱和Na2CO3溶液
B
通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失.
Na2SiO3溶液
C
通入CO2,溶液变浑浊,继续通入CO2至过量,沉淀不消失.再加入品红溶液,红色褪去.
Ca(ClO)2溶液
D
通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失.再加入足量NaOH溶液,又变浑浊.
Ca(OH)2溶液
|
A.A
B.B
C.C
D.D
参考答案:A.向饱和Na2CO3溶液中通入二氧化碳,会发生反应生成碳酸氢钠,碳酸氢钠的溶解度小于碳酸钠,所以会析出碳酸氢钠晶体,故A正确;
B.向Na2SiO3溶液中通入二氧化碳,会产生硅酸,是白色不溶于水的沉淀,继续通CO2至过量,浑浊不会消失,故B错误;
C.向Ca(ClO)2溶液中通入二氧化碳,会生成碳酸钙和次氯酸,碳酸钙在过量二氧化碳存在下会转化为碳酸氢钙,沉淀消失,次氯酸具有强氧化性,可使品红褪色,故C错误;
D.氢氧化钙中通二氧化碳会生成碳酸钙沉淀,再转化为碳酸氢钙,碳酸氢钙和氢氧化钠反应会生成碳酸钙,故D正确.
故选AD.
本题解析:
本题难度:简单
5、实验题 某学校化学兴趣小组想利用元素周期表中第三周期的某些元素探究元素的金属性和非金属性随原子序数变化的规律。该兴趣小组选择的实验仪器和试剂:烧杯、试管、酒精灯、蒸馏水、稀盐酸、酚酞溶液等。
(1)根据上述实验仪器和试剂,该兴趣小组要进行实验探究的元素是____________。
(2)在探究上述元素的单质与水反应时,为了保证实验的安全性,应该在________(填“试管”或“烧杯”)中进行反应,为了切实保证不出危险,还需进行的操作有________________。
(3)在水中滴入1 mL酚酞试剂,但实验时(包括实验后),发现只有钠与水反应的溶液显红色,于是有位 同学得出结论:钠、镁、铝中只有钠能与水反应。你觉得这个结论_________(填“正确”或“不正确”),如果不正确,请你还利用水这种“试剂”来设计实验探究镁与铝的金属性强弱。你的实验设计是__________________。并预测实验现象________________________。
(4)小组中的另外一位同学设计实验用酸来探究这些金属的金属性,但老师删掉了该同学设计的酸与钠反 应的实验,你觉得老师这样做的目的是__________________。该同学在两支试管中各加入2 mL 稀盐酸,然后在其中一支试管中加入2片镁片,另外一支试管中加入2片铝片,反应开始的时候现象是__________________。不过该同学操作时在第二支试管中加入了两块质量较大的铝条,他观察到随着反应的进行,铝与酸的反应越来越快,直至最后反应几乎呈沸腾状态,请你推测铝与盐酸产生这种现象的原因是_________________________。
(5)最后该小组得出实验结论:______________________。
参考答案:(1)钠、镁、铝
(2)烧杯;在烧杯上放一块玻璃片
(3)不正确;在两支试管中分别加入2 mL蒸馏水,再在其中分别滴入2~3滴酚酞试剂,然后在一支试管中加入2片镁片,另外一支试管中加入2片铝片,最后用酒精灯加热,观察试管内溶液颜色的变化;镁片在热水中有气泡产生,水溶液变为浅红色
(4)因为钠与酸反应非常剧烈,防止发生爆炸事故;镁与盐酸反应剧烈,而铝与盐酸能够反应;该反应是放热反应,随着反应的进行,反应液的温度升高,反应速率变快
(5)随着原子序数的递增,钠、镁、铝的金属性逐渐减弱,故同周期元素随着元素序数的递增,元素的金属性逐渐减弱(或非金属性逐渐增强)
本题解析:
本题难度:一般