微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (11分)某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,注入0.2000mol·L-1的标准NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
⑥重复以上滴定操作2-3次。
请回答:
(1)以上步骤有错误的是(填编号)________,该错误操作会导致测定结果_________
(填“偏大”、“偏小”或“无影响”)。
(2)步骤④中,量取20.00mL待测液应使用__________________(填仪器名称),在锥形瓶装液前,留有少量蒸馏水,测定结果____________(填“大”、“偏小”或“无影响”)。
(3)步骤⑤滴定时眼睛应注视 _______________________________判断到达滴定终点的依据是:__________________________________________________。
(4)以下是实验数据记录表
滴定次数
| 盐酸体积(mL)
| NaOH溶液体积读数(mL)
|
滴定前
| 滴定后
|
1
| 20.00
| 0.00
| 18.10
|
2
| 20.00
| 0.00
| 16.30
|
3
| 20.00
| 0.00
| 16.22
|
从上表可以看出,第1次滴定记录的NaOH溶液体积明显多于后两次的体积,其可能的原因是(?)
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.锥形瓶用待测液润洗
C.NaOH标准液保存时间过长,有部分变质
D.滴定结束时,俯视计数
(5) 根据上表记录数据,通过计算可得,该盐酸浓度为:____________mol·L-1
参考答案:(11分)(1)①(1分)偏大(1分)?
(2)酸式滴定管(或移液管)(1分)?无影响(1分)
(3)锥形瓶中溶液颜色变化(1分)
锥形瓶中溶液由无色变为浅红色(1分),半分钟不变色(1分)
(4)A B(2分)(5)0.1626(2分)
本题解析:(1)盛装标准液的碱式滴定管必须用NaOH溶液润洗,否则将导致标准液的浓度偏小,所消耗标准液的体积偏大,导致测定结果偏大
(2)精确量取待测液体积应选用较精密仪器:酸式滴定管(或移液管)
锥形瓶中即使有少量水,但不能改变溶液中H+的总量,故对测定结果无影响
(3)滴定时眼睛应观察锥形瓶中溶液颜色变化;
当溶液由酸性到滴定终点时,指示剂酚酞颜色由无色转变为粉红色,且半分钟不变色
(4)A.标准液占据了气泡的体积,但并没有用于滴定,即标准液体积偏大
B.锥形瓶用待测液润洗,将导致酸所提供的H+偏多,所消耗标准液体积偏大
C.滴定终点时,溶液为NaCl溶液,即使NaOH会吸收空气中的CO2,部分变质,但并不影响所用标准液体积
D.滴定结束时,俯视计数,导致标准液的体积偏小
(5)由于第1次滴定记录的NaOH溶液体积明显多于后两次的体积,故只将后两次标准液体积求平均值,即16.26ml;c(HCl)×0.02=0.2×0.01626,则c(HCl)=0.1626mol·L-1
本题难度:一般
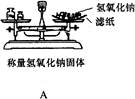
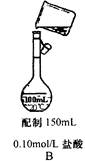
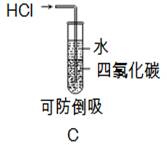
2、选择题 下列实验装置图和相关操作正确的是
 ?
?
参考答案:
C
本题解析:
在A项中,称量氢氧化钠固体时,氢氧化钠是不能直接放在滤纸上进行称量,因为氢氧化钠固体易潮解,应放在小烧杯中进行称量。在B项中,将溶液转移到容量瓶中时,应用玻璃棒进行引流,它没有用玻璃棒进行引流; C项,HCl气体出口不和水接触.可防止倒吸. 在D项中,分离硝酸钾与氯化钠不能用蒸馏法,应用降温结晶法。
本题难度:一般
3、实验题 某兴趣小组通过实验探究溶解铜的方法和本质。
(1)在热水浴中进行3个实验,部分实验报告如下表所示。

①实验I、Ⅱ的目的是____;
②实验Ⅲ中反应的本质是(用离子方程式表示)____________________
(2)利用电化学原理实现铜溶于稀硫酸并生成氧气。
①Cu作____极; ②总反应的离子方程式是________________。
参考答案:(1)①证明Cu不与H+、NO3-单独反应;②3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
(2)①阳;②Cu+2H+ Cu2++H2↑
Cu2++H2↑
本题解析:
本题难度:一般
4、实验题 某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题
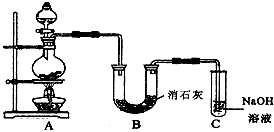
(1)在A装置中用固体二氧化锰与浓盐酸在加热条件下制取氯气,反应原理为:
MnO2+4HCl(浓)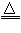 MnCl2+Cl2↑+2H2O,请在该反应方程式中标出电子转移方向和数目,
MnCl2+Cl2↑+2H2O,请在该反应方程式中标出电子转移方向和数目,
_________________________并指出氧化剂为_______________,还原剂为________________
(2)漂白粉将在U形管中产生,其化学方程式是____________________________
(3)C装置的作用是____________________________
(4)此实验所得漂白粉的有效成分偏低。该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是
____________________________
②试判断另一个副反应(用化学方程式表示)____________________________为避免此副反应的发生,可将装置作何改进____________________________
参考答案:(1)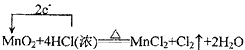 ;MnO2;HCl
;MnO2;HCl
(2)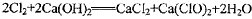
(3)吸收多余的氯气,防止氯气外逸污染空气
(4)①将U形管用冷水浴降温(或降温);
②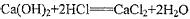 ;在A和B之间连接一个能吸收浓盐酸挥发出来的HCl的洗气瓶
;在A和B之间连接一个能吸收浓盐酸挥发出来的HCl的洗气瓶
本题解析:
本题难度:一般
5、实验题 某小组的同学对放置已久的过氧化钠的成份进行探究,请回答下列问题:
(1)反应2Na2O2+2H2O==4NaOH+O2↑的还原剂是______________(写化学式);反应2Na2O2+2CO2==
2Na2CO3+O2↑中,每生成1molO2则转移了_________mol电子。
进行探究:
(2)提出假设。 假设1:全部是Na2O2 假设2:全部是Na2CO3 假设3:__________________
(3)设计方案,进行实验。请写出实验步骤以及预期现象和结论(可不填满)。限选实验试剂和仪器:蒸馏水、1moLL-1H2SO4、澄清石灰水、淀粉-KI溶液、酚酞溶液、火柴、试管、小烧杯。
③
参考答案:(1)Na2O2;2
(2)假设3:是Na2O2与Na2CO3的混合物 (3)
本题解析:
本题难度:困难