微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某研究性学习小组用下图装置进行SO2与FeCl3溶液反应的相关实验。(夹持装置已略去)
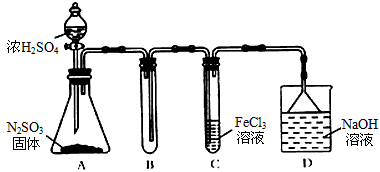
(1)在配制氯化铁溶液时需先把氯化铁晶体溶解在_________ 中,再加水稀释,这样操作的目的是______________________,操作中不需要的仪器有____(填入正确选项前的字母);
a.药匙 b.烧杯 c.石棉网 d.玻璃棒 e.坩埚
(2)通入足量SO2时C装置中观察到的现象为____________________
(3)根据以上现象,该小组同学认为SO2与Fe3+反应生成SO42-和Fe2+。
①写出SO2与Fe3+反应的离子方程式________________________;
②请设计实验方案检验C试管中生成的Fe2+:________________________
③该小组向C装置反应后的溶液中加入稀硝酸酸化的BaCl2溶液,出现白色沉淀,证明反应生成了SO42-,该做法______(填“合理”或“不合理”),理由是__________________
(4)D装置中倒置漏斗的作用是___________________
(5)为了验证SO2具有还原性,实验中可以代替FeCl3溶液的试剂是_________(填字母)
a.浓H2SO4 b.酸性KMnO4溶液 c.碘水 d.Na2S溶液
参考答案:(1)浓盐酸;抑制氯化铁水解;ce
(2)溶液由棕黄色变为浅绿色
(3)①2Fe3++SO2+2H2O=SO42-+4H++2Fe2+;②取装置C中反应后的溶液,向其中滴入KSCN溶液,不变 红,再加新制氯水,溶液变红(合理即可);③不合理;硝酸可以将溶解的SO2氧化为H2SO4,干扰实验 (4)使气体充分吸收、防止溶液倒吸
(5)bc
本题解析:
本题难度:一般
2、选择题 分析推理是化学学习方法之一。下列实验推理中,正确的是
A.灼热的铂丝与NH3、O2混合气接触,铂丝保持红热,说明氨的氧化反应是放热反应
B.某雨水的pH小于5.6,说明雨水中一定溶解了SO2
C.某溶液中加入氯化钡溶液,生成白色沉淀,说明原溶液中一定含有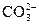
D.将镁条和铝片用导线连接再插进稀NaOH溶液,镁条上产生气泡,说明镁比铝活泼
参考答案:A
本题解析:B错,NO2溶于水,也呈弱酸性;C错,也可能含Ag+或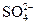 ;D错,发生氧化还原反应,该过程是原电池装置中的特例。
;D错,发生氧化还原反应,该过程是原电池装置中的特例。
本题难度:简单
3、简答题 某化学兴趣小组从有机废液中(主要含甲苯、二甲苯、苯酚)提取苯酚的流程图如图所示: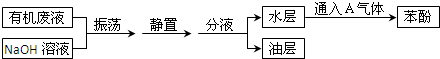
请填写下列空白:
(1)A的化学式是______.
(2)振荡的目的是______.
(3)分液操作需要的最关键的玻璃仪器是______,使用该仪器时第一步操作是______.
(4)写出水层中有关物质与A气体反应生成苯酚的化学方程式:______.
参考答案:苯、二甲苯、苯酚三种物质中只有苯酚和NaOH反应生成溶于水的苯酚钠,经振荡、静置、分液后得到的水层为苯酚钠溶液,由于苯酚的酸性比碳酸弱,在溶液中通入二氧化碳气体可得到苯酚,
(1)由以上分析可知A为CO2,故答案为:CO2;
(2)由于苯、二甲苯、苯酚混溶,为使苯酚与NaOH充分反应,应充分振荡,可使苯酚与NaOH充分接触而反应,
故答案为:使苯酚与氢氧化钠充分反应;
(3)分液时常用分液漏斗分离互不相溶的两种液体混合物,使用前应检验是否漏液,
故答案为:分液漏斗;检验分液漏斗是否漏液;
(4)苯酚的酸性比碳酸弱,在苯酚钠溶液中通入二氧化碳生成苯酚,反应的方程式为C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,
故答案为:C6H5ONa+CO2+H2O→C6H5OH+NaHCO3.
本题解析:
本题难度:简单
4、填空题 二氧化钛(TiO2)广泛用于制造高级白色油漆,也是许多反应的催化剂.工业上用钛铁矿[主要成分为FeTiO3(钛酸亚铁,不溶于水)、Fe2O3及少量SiO2杂质]作原料,制取二氧化钛及绿矾,其生产流程如下:
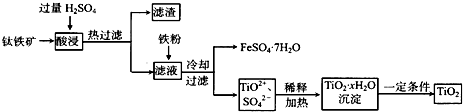
回答下列问题:
(1)Ti原子序数为22,则Ti位于周期表第______周期,第______列.
(2)FeTiO3溶于过量硫酸的离子方程式______.
(3)流程中生成TiO2?xH2O离子方程式为______.
(4)若铁粉的用量不足,可能导致产品TiO2中混有______杂质.
(5)以TiO2为原料制取金属钛的其中一步反应为TiO2+Cl2+C
TiCl4+______,已知该反应中氧化剂与还原剂的物质的量之比为1:1,则另一生成物为______.
(6)TiCl4?在常温下呈液态,且极易水解,可以用作军事烟雾剂;写出其水解反应的方程式______.
参考答案:(1)22-2-8-8=4,故Ti元素处于第四周期,第4列.
故答案为:四、4.
(2)由工艺流程转化关系可知,FeTiO3溶于过量硫酸,生成Fe2+、TiO2+、H2O,反应离子方程式为FeTiO3+4H+=Fe2++TiO2++2H2O.
故答案为:FeTiO3+4H+=Fe2++TiO2++2H2O.
(3)由工艺流程转化关系可知,TiO2+在加热条件下与水反应生成TiO2?xH2O,根据电荷守恒可知还生成H+,所以反应离子方程式为TiO2++(x+1)H2O=TiO2?xH2O+2H+.
故答案为:TiO2++(x+1)H2O=TiO2?xH2O+2H+.
(4)铁粉的用量不足,滤液中的Fe3+,不能除尽.生成的TiO2?xH2O沉淀中含有氢氧化铁,最后氢氧化铁分解生成氧化铁,所以可能导致产品TiO2中混有Fe2O3.
故答案为:Fe2O3.
(5)反应中Ti元素化合价未变化,氯元素化合价由0价降低为-1价,令碳元素在产物中等化合价为a,则a=2×[0-(-1)],故a=2,反应中氧化剂与还原剂的物质的量之比为1:1,结合元素守恒可知,TiO2、Cl2、C、TiCl4的系数分别为1、2、2、1,所以未知物中含有C原子与O原子,碳元素化合价为+2,故为CO,系数为2.
故答案为:2CO;CO.
(6)TiCl4?水解,生成H2TiO3与HCl,H2TiO3是固体颗粒,HCl与空气中水蒸气结合呈白雾,可以用作军事烟雾剂.水解方程式为TiCl4?+3H2O=H2TiO3+3HCl↑.
故答案为:TiCl4?+3H2O=H2TiO3+3HCl↑.
本题解析:
本题难度:一般
5、选择题 用下列实验装置完成对应的实验,无明显错误或不足的是
参考答案:
A
本题解析:
本题考查化学实验知识,关键明确各种实验装置的用途。A项中氨气通过CCl4后再被稀硫酸吸不会引起倒吸,A正确;B项中少了环形玻璃搅拌棒,不正确;C项中易发生倒吸,C错;NO不能排气收集,被氧化为NO2,不正确。
本题难度:一般