微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 已知草酸是酸性强于醋酸的二元弱酸,对应的钙盐(CaC2O4)不溶于醋酸,能溶于强酸,它还是一种还原性较强的物质。下图是利用饱和草酸溶液与KClO3粉末在60℃时反应制得Cl O2,ClO2是一种黄绿色有刺激性气味的气体,熔点-59℃,沸点11.0℃

(1)该反应的反应原理为以下化学方程式,试配平:
___KClO3+____H2C2O4?→____KHCO3+____ClO2↑
(2)B装置的作用是_________________________________。
(3)C装置是尾气处理装置,反应一段时间后,C中含有NaOH、NaClO2、NaClO3等溶质,有同学说,C中还可能含有Na2CO3,试分析可能的原因?_________________?。
(4)某同学查资料得知“菠菜中富含可溶性草酸盐和碳酸盐”,他将菠菜研磨成汁、热水浸泡、过滤得到溶液,调节溶液呈碱性,加入足量的CaCl2溶液,产生白色沉淀,过滤、洗涤,沉淀备用,对生成的沉淀进行探究。
①提出合理假设
假设1:只存在CaCO3;
假设2:既存在CaCO3,也存在CaC2O4;
假设3:_____________________。
②基于假设2,设计实验方案,进行实验。请在下标中写出实验步骤以及预期现象和结论。限选实验试剂:1?mol/L?H2SO4、0.1?mol/L?HCl、0.01?mol/L?KMnO4、澄清石灰水。
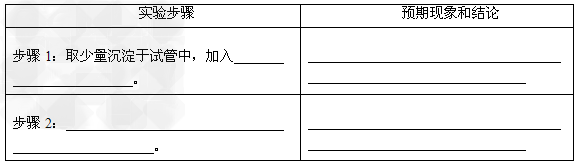
参考答案:(1)?2?1?2?2
(2)将ClO2冷凝收集
(3)过量的草酸与KHCO3反应,逸出的CO2与NaOH溶液反应生成Na2CO3。(或因KClO3具有较强氧化性,将草酸氧化成CO2,逸出的CO2与NaOH溶液反应生成Na2CO3)
(4)①只存在CaC2O4? ②

本题解析:
本题难度:一般
2、选择题 能把Na2SO4、NH4NO3、KCl、(NH4)2SO4四瓶无色溶液加以区别的一种试剂是(必要时可加热)( )
A.BaCl2
B.NaOH
C.Ba(OH)2
D.AgNO3
参考答案:A.BaCl2与Na2SO4、(NH4)2SO4两瓶无色溶液反应,均生成白色沉淀,现象相同,无法区别,故A错误;
B.NaOH与NH4NO3、(NH4)2SO4两瓶无色溶液反应,均生成刺激性气味的气体,现象相同,无法区别,故B错误;
C.Na2SO4、NH4NO3、KCl、(NH4)2SO4四瓶无色溶液分别与Ba(OH)2反应,现象分别为:白色沉淀、刺激性气味的气体、无现象、既有沉淀又有刺激性气味的气体,现象各不相同,能够区别,故C正确;
D.AgNO3与Na2SO4、KCl、(NH4)2SO4三瓶无色溶液反应,均生成白色沉淀,现象相同,不能区别,故D错误;
故选C.
本题解析:
本题难度:一般
3、填空题 (16分)某混合金属粉末,铝处还含有铁、铜中的一种或两种,所含金属的量都在5%以上。请设计合理实验探究该混合物金属粉末中铁、铜元素的存在。仅限选择的仪器和试剂:烧杯、试管、玻璃棒、量筒、容量瓶、滴管、药匙;1mol/L硫酸、2 mol/L硝酸、2mol/LNaOH溶液、20%KSCN溶液。完成以下实验探究过程:
mol/L硝酸、2mol/LNaOH溶液、20%KSCN溶液。完成以下实验探究过程:
[提出假设]?假设1?该混合金属粉末中除铝外还含有?元素;
假设2?该混合金属粉末中除铝外还含有?元素;
假设3?该混合金属粉末中除铝外还含有Fe、Cu元素;
[设计实验方案]基于假设3,设计出实验方案(不要在答题卡上作答)。
[实验过程]根据上述实验方案,完成实验的相关操 作、预期现象和结论。
作、预期现象和结论。
编号
| 实验操作
| 实验现象
| 结论
|
①
| 用药匙取少许样品,加入试管A中,再用滴管取过量? ?____?溶液并滴加到试管A中,充分反应 ?____?溶液并滴加到试管A中,充分反应
| 有固体剩余,并有气泡产生
| 合金中除铝外还含有Fe、Cu
元素
|
②
| 往试管A的剩余固体中加过量? ________?,充分反应后,静置,取上层清液于试管B中
| 固体部分溶解,并有气体放出,溶液呈浅绿色
|
③
| 往试管B中加入少量? _____,再滴加KSCN溶液
| ? _____
|
④
| 往②剩余固体中加入稀硝酸;再滴加? ____________ 溶液.
| 固体溶解,有无色刺激性气体产生并很快变成红棕色,溶液显蓝色;再加某溶液后有蓝色沉淀产生
|
[反思】写出在实验①中发生反应的离子方程式:? ___________ 。
参考答案:(共16分,每空2分)
【提出假设】?假设1 铁;?假设2 铜(不分先后顺序,写化学式也得分)
【实验过程】
编号
实验操作
实验现象
结论
①
NaOH溶液
?
?
②
硫酸
?
③
硝酸
溶液从浅绿色变为黄色,再变为血红色(写到“血红色”给满分)
④
NaOH溶液
?
本题解析:略
本题难度:一般
4、实验题 (15分)氰化物有剧毒,冶金工业会产生大量含氰化物的废水,其中氰化物以CN—等形式存在于废水中。某化学小组同学对含氰化物废水处理进行研究。
I.查阅资料:含氰化物的废水破坏性处理方法。
利用强氧化剂将氰化物氧化为无毒物质,如以TiO2为催化剂用NaClO将CN-离子氧化成CNO-(CN-和CNO-中N元素均为-3价),CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等。
II.实验验证:破坏性处理CN-的效果。
化学兴趣小组的同学在密闭系统中用图10装置进行实验,以测定CN-被处理的百分率,实验步骤如下:
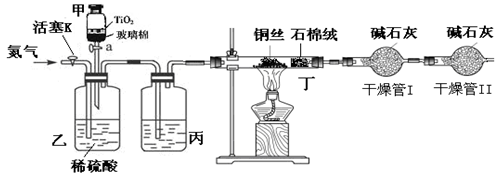
步骤1:取一定量废水进行加热蒸发、浓缩。
步骤2:取浓缩后含CN-离子的废水与过量NaClO溶液的混合液共200mL(设其中CN-的浓度为0.2mol·L—1)倒入甲中,塞上橡皮塞。
步骤3:?
步骤4:打开甲上的橡皮塞和活塞,使甲中溶液全部放入乙中,关闭活塞。
步骤5:打开活塞K,通一段时间N2,关闭活塞K。
步骤6:实验完成后测定干燥管I(含碱石灰)的质量m2(实验前干燥管I(含碱石灰)的质量m1)
回答下列问题:
(1)在破坏性处理方法中,在酸性条件下NaClO和CNO-反应的离子方程式?。
(2)完成步骤3?。
(3)丙装置中的试剂是?,丁装置的目的是?。
(4)干燥管Ⅱ的作用是?。
(5)请简要说明实验中通入N2的目的是?。
(6)若干燥管Ⅰ中碱石灰增重1.408g,则该实验中测得CN-被处理的百分率为?。
参考答案:(1)2CNO—+6ClO—+8H+=2CO2↑+N2↑+Cl2↑+4H2O?(2分)
(2)点燃酒精灯对丁装置加热(2分)?(3)浓硫酸;除去Cl2(各2分)
(4)防止空气中的水和CO2进入干燥管I中影响对CO2的测量(2分)
(5)使装置中的CO2全部到干燥管I中被吸收,减少误差。(2分)?(6)80%(3分)
本题解析:(1)次氯酸钠具有强氧化性,能把CNO—氧化生成氮气和CO2,所以反应式为2CNO—+6ClO—+8H+=2CO2↑+N2↑+Cl2↑+4H2O。
(2)由于需要通过加热的铜丝吸收氯气,所以应该先点燃丁处的酒精灯。
(3)因为生成的气体需要干燥,所以丙装置中应该盛放浓硫酸,干燥CO2气体。
(4)干燥管I是吸收CO2的,因此为了防止空气中的水和CO2进入干燥管I中影响对CO2的测量,需要再连接1个干燥管。
(5)由于装置中会残留部分CO2,所以通入氮气的目的是使装置中的CO2全部到干燥管I中被吸收,减少误差。
(6)干燥管Ⅰ中碱石灰增重1.408g,则反应中生成的CO2是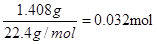 ,所以CNO—的物质的量是0.032mol。CN-的总的物质的量是0.04mol,所以根据原子守恒可知,该实验中测得CN-被处理的百分率为80%。
,所以CNO—的物质的量是0.032mol。CN-的总的物质的量是0.04mol,所以根据原子守恒可知,该实验中测得CN-被处理的百分率为80%。
本题难度:一般
5、选择题 下列实验操作中错误的是(? )?
A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
C.蒸发结晶时应将溶液蒸干
D.称量时,称量物放在称量纸上,置于天平左盘,砝码放在天平右盘中
参考答案:C
本题解析:蒸发时,如果出现大量的固体时,就应该停止加热,利用余热蒸干即可,选项C不正确,其余选项都是正确的,答案选C。
点评:化学实验常用仪器的使用方法和化学实验基本操作是进行化学实验的基础,对化学实验的考查离不开化学实验的基本操作,该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力。
本题难度:简单