微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 工业上为从4J29合金(铁钴镍合金)废料中提取钴和镍,一般先用硫酸溶解合金,使其转化为Fe2+、Co2+、Ni2+,再把Fe2+氧化为Fe3+,从而使Fe3+转化为某种沉淀析出,达到与Ni2+、Co2+分离的目的.生产上要使Fe2+氧化为Fe3+,而不使Co2+、Ni2+氧化的试剂是NaClO或NaClO3(均含少量H2SO4)溶液.反应的部分化学方程式如下(A为还原剂):?
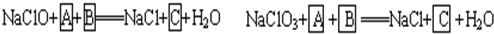
试回答下列问题:
(1)上述反应中,A为:______(写化学式,下同),C为:______.
(2)配平下列离子方程式:?
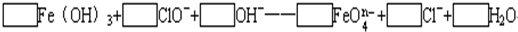
(3)已知有3.21g?Fe(OH)3参加反应,共转移了5.42×1022个电子,则n=______,FeO
中铁的化合价为______.
(4)根据(2)、(3)推测FeO能与下列哪些物质反应(只填序号)______.
A.Cl2?B.SO2C.H2S?D.O2?
参考答案:(1)根据题意知,次氯酸钠和氯酸钠都是氧化剂,A是还原剂,则A失电子化合价升高,且溶液中含有硫酸,所以A中含有硫酸根离子且具有还原性,结合实验目的把Fe2+氧化为Fe3+从而使Fe3+转化为某种沉淀析出知,A是硫酸亚铁,B是硫酸,结合元素守恒知,C是硫酸铁,
故答案为:FeSO4,Fe2(SO4)3;
(2)该反应中铁元素的化合价+3→+(8-n),失去(5-n)个电子,氯元素的化合价+1→-1价,得到2个电子,得失电子的最小公倍数是2(5-n),所以氢氧化铁的计量数是2,次氯酸根离子的计量数是5-n,然后根据原子守恒配平方程式得
2Fe(OH)3+(5-n)ClO-+2nOH-=2 FeO4n-+(5-n)Cl-+(n+3)H2O,
故答案为2、5-n、2n、2、5-n、n+3;
(3)2Fe(OH)3+(5-n)ClO-+2nOH-=2FeO4n-+(5-n)Cl-+(n+3)H2O转移电子
? 214g? 2(5-n)×6.02×1023?
? 3.21g?5.42×1022
?n=5-214×5.42×10223.21×2×6.02×1023=2,FeO42-中铁的化合价=-2-(-2)×4=+6,
故答案为:2,+6;?
(4)FeO42-中铁元素化合价是最高价,所以该离子具有强氧化性,能和强还原性的物质反应,氯气和氧气具有强氧化性,所以不能和高铁酸根离子反应,二氧化硫和硫化氢具有强还原性,所以能和高铁酸根离子反应,故选B、C.
本题解析:
本题难度:一般
2、选择题 实现下列变化,一定要加入氧化剂的是
A.HCl→Cl2
B.Na2SO3→SO2
C.HCl→H2
D.HNO3→NO
参考答案:A
本题解析:说明选项中物质被氧化,其元素化合价将升高,只有A项符合题意
本题难度:简单
3、选择题 氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:aHClO3=bO2↑+cCl2↑+dHClO4+eH2O,下列说法正确的是(? )
A.由反应可知,氧气、氯气均为氧化产物
B.若化学计量数a=8,则该反应转移电子数为12e-
C.若b确定,则方程式中其他物质的化学计量数均能确定
D.若氯酸分解所得混合气体,1 mol混合气体质量为51.5 g,则反应方程式可表示为:5HClO3=O2↑+Cl2↑+3HClO4+H2O
参考答案:D
本题解析:O2和HClO4均为氧化产物,Cl2为还原产物,因此c的值取决于b、d的值,根据电子守恒有2c×5=4b+2d,a=8时,方程式为:8HClO3=3O2↑+2Cl2↑+4HClO4+2H2O,转移电子数为20e-。只确定b无法确定方程式中其他物质的化学计量数。1 mol混合气体质量为51.5 g,即O2和Cl2的混合气体的平均相对分子质量为51.5,用十字交叉法,可以得出二者物质的量之比为1:1,再根据电子守恒,物质的化学计量数均可得出。
本题难度:一般
4、填空题 (3分)工业上冶炼金属铁的主要反应为:Fe2O3 + xCO  2Fe + 3CO2
2Fe + 3CO2
其中该化学方程式中x的数值是?, CO作?(填“氧化剂”或“还原剂”)。在该反应中,若消耗了1 mol Fe2O3,则生成?mol Fe。
参考答案:3,还原剂,2
本题解析:根据原子守恒可知,x=3;根据方程式可知,碳元素的化合价从+2价升高到+4价,失去电子,所以CO是还原剂;根据铁元素守恒可知,如果消耗了1 mol Fe2O3,则生成2mol单质铁。
点评:氧化还原反应的有关判断关键是准确判断元素化合价的变化。
本题难度:一般
5、计算题 将25.6g铜与含0.3molH2SO4的浓硫酸充分反应,(1)若在反应过程中消耗了0.2mol的H2SO4,则生成的气体标况下体积为多少?(2)若以上反应产生的气体全部逸出后,继续在剩余物质中加入2mol/L的稀硝酸100ml,充分反应后产生NO的物质的量为多少?
参考答案:(1)2.24L?(2)0.1mol
本题解析:(1)铜与浓硫酸反应产生的气体为二氧化硫气体,Cu+2H2SO4 CuSO4+SO2↑+2H2O,被还原的硫酸占参加反应的硫酸的一半,所以消耗0.2mol硫酸有0.1mol的硫酸被还原,则有0.1mol的二氧化硫生成,所以生成气体的体积为标准状况下2.24L
CuSO4+SO2↑+2H2O,被还原的硫酸占参加反应的硫酸的一半,所以消耗0.2mol硫酸有0.1mol的硫酸被还原,则有0.1mol的二氧化硫生成,所以生成气体的体积为标准状况下2.24L
(2)由(1)知硫酸耗用铜0.1mol,质量为6.4g,余19.2g铜,余0.1mol H2SO4,加入2mol/L的稀硝酸100ml此时溶液中n(H+)=0.2+0.2=0.4mol,n(NO3-)=0.2mol,n(Cu)=0.3mol,铜与稀硝酸反应的离子方程式为
3Cu+8H++2 NO3-= 3Cu2++2NO↑+4 H2O,所以H+不足,按H+计算,因此生成NO的物质的量为0.1mol。
本题难度:一般