微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 针对苏教版化学1第75页上“铁与氧化性较弱的氧化剂(如盐酸、硫酸铜溶液等)反应转化为+2价铁的化合物,如果与氧化性较强的氧化剂(如氯气、双氧水等)反应则转化为+3价的化合物”的叙述,化学研究性学习小组拟通过以下实验探究“新制的还原性铁粉和盐酸的反应(铁过量)”.请你参与探究并回答有关问题:
(1)利用KSCN、H2O2等药品检验反应后的混合液中含有二价铁的实验方法和现象是______;但在实验中往往又看到红色迅速褪去,同时溶液呈黄色,其可能的原因是______;学生在做实验时往往滴加双氧水的浓度过大,或者过量,还看到迅速产生大量气泡,写出该现象产生的化学方程式:______.
(2)有资料介绍“取少量反应液(含二价铁)先滴加少量新制饱和氯水,然后滴加KSCN溶液,呈现血红色.若再滴加过量新制氯水,却发现红色褪去.同学对红色褪去的原因提出各自的假设.某同学的假设是:溶液中的+3价铁被氧化为更高的价态.”如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式______.
(3)探究高铁酸钾的某种性质.
【实验一】将适量K2FeO4固体分别溶解于pH?为?4.74、7.00、11.50?的水溶液中,配得FeO42-浓度为?1.0mmol?L-1(1mmol?L-1=10-3mol?L-1)的试样,静置,考察不同初始?pH?的水溶液对K2FeO4某种性质的影响,结果见图1(注:800min后,三种溶液中高铁酸钾的浓度不再改变).


【试验二】将适量?K2FeO4溶解于pH=4.74?的水溶液中,配制成FeO42-浓度为?1.0mmol?L-1?的试样,将试样分别置于?20℃、30℃、40℃和?60℃的恒温水浴中,考察不同温度对K2FeO4某种性质的影响,结果见图2.则
①实验1的目的是______;
②实验2可得出的结论是______;
③高铁酸钾在水中的反应为4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2↑.由图1可知,800min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是______.
参考答案:(1)因亚铁离子具有还原性,铁离子遇KSCN溶液显血红色,则KSCN、H2O2等药品检验反应后的混合液中含有二价铁的实验方法和现象是先加硫氰化钾溶液,无现象,再滴加双氧水少许,看到溶液呈血红色;在实验中往往又看到红色迅速褪去,同时溶液呈黄色,其可能的原因是硫氰根被氧化;做实验时往往滴加双氧水的浓度过大,或者过量,还看到迅速产生大量气泡,发生2H2O2?FeCl3?.?2H2O+O2↑,
故答案为:先加硫氰化钾溶液,无现象,再滴加双氧水少许,看到溶液呈血红色;硫氰根被氧化;2H2O2?FeCl3?.?2H2O+O2↑;
(2)由信息可知,铁离子被氯气氧化为FeO42-和盐酸,该离子反应为2Fe3++3Cl2+8H2O═2FeO42-+6Cl-+16H+,
故答案为:2Fe3++3Cl2+8H2O═2FeO42-+6Cl-+16H+;
(3)①由实验一可知,pH不同,FeO42-稳定性不同,则实验1的目的为研究FeO42-在不同pH溶液中的稳定性(或反应的速率),
故答案为:研究FeO42-在不同pH溶液中的稳定性(或反应的速率);
②由图2可知,温度不同,FeO42-稳定性不同,所以实验2可得出的结论是温度越高,FeO42-越不稳定(或与水反应的速率越快),
故答案为:温度越高,FeO42-越不稳定(或与水反应的速率越快);
③由图1可知,800min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,因pH=11.50的溶液中OH-离子浓度大,使4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2↑平衡向左移动,
故答案为:pH=11.50的溶液中OH-离子浓度大,使平衡向左移动.
本题解析:
本题难度:一般
2、选择题 下列物质受热后稳定不变的是( )
A.FeO
B.NaHCO3
C.Al(OH)3
D.Na2CO3
参考答案:D
本题解析:
本题难度:简单
3、填空题 钢铁工业对促进经济和社会发展起了重要作用。



 (1)炼铁高炉分为五部分,铁矿石与高温煤气主要在?部分发生反应,在?部分开始生成铁和炉渣。
(1)炼铁高炉分为五部分,铁矿石与高温煤气主要在?部分发生反应,在?部分开始生成铁和炉渣。
 (2)炼钢时,除磷的化学方程式为?;
(2)炼钢时,除磷的化学方程式为?;
 加入硅、锰和铝的目的是?。
加入硅、锰和铝的目的是?。
 (3)不锈钢含有的Cr元素是在炼钢过程的氧吹?(填“前”或“后”)加入,原因是?。
(3)不锈钢含有的Cr元素是在炼钢过程的氧吹?(填“前”或“后”)加入,原因是?。
 (4)炼铁和炼钢生产中,尾气均含有的主要污染物是?。
(4)炼铁和炼钢生产中,尾气均含有的主要污染物是?。
 从环保和经济角度考虑,上述尾气经处理可用作?。
从环保和经济角度考虑,上述尾气经处理可用作?。
参考答案:(1)炉身?炉腰

 (2)2P+5FeO+3CaO? Ca3(PO4)2+5Fe?脱氧和调整钢的成分
(2)2P+5FeO+3CaO? Ca3(PO4)2+5Fe?脱氧和调整钢的成分
 (3)后?避免Cr被氧化(或“氧吹前加入Cr会形成炉渣被除去”)
(3)后?避免Cr被氧化(或“氧吹前加入Cr会形成炉渣被除去”)
 (4)CO?燃料(或还原剂)
(4)CO?燃料(或还原剂)
本题解析: (1)高炉炼铁,铁矿石的主要反应是在炉身部分发生,在炉腰处生成生铁和炉渣。
(1)高炉炼铁,铁矿石的主要反应是在炉身部分发生,在炉腰处生成生铁和炉渣。

 (2)除钢中的磷的化学方程式为2P+5FeO+3CaO? Ca3(PO4)2+5Fe,加入硅、锰和铝的目的是脱去氧和调整钢中的成分。
(2)除钢中的磷的化学方程式为2P+5FeO+3CaO? Ca3(PO4)2+5Fe,加入硅、锰和铝的目的是脱去氧和调整钢中的成分。
 (3)为了防止Cr元素被高温下的氧氧化,应在氧吹后加入。
(3)为了防止Cr元素被高温下的氧氧化,应在氧吹后加入。



 (4)炼铁时用到C作燃料生成CO作还原剂,炼钢时钢中本身含有C,因此都有CO产生,而CO是有毒气体,对环境有污染,同时CO可以燃烧生成CO2。
(4)炼铁时用到C作燃料生成CO作还原剂,炼钢时钢中本身含有C,因此都有CO产生,而CO是有毒气体,对环境有污染,同时CO可以燃烧生成CO2。
本题难度:一般
4、填空题 将1.000gFeC2O4·2H20固体样品放在热重分析仪中进行热重分析,測得其热重分析曲线(样品质量随温度变化的曲线)如下图所示:
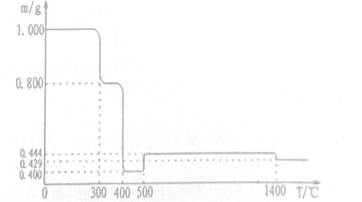
已知:①草酸盐受热分解易放出碳的氧化物。②5000C之前,该热重分析仪的样品池处于Ar气气氛中,5000C时起,样品池与大气相通。完成下列填空:
(1)3000C时是样品脱水的过程,试确定3500C时样品是否脱水完全_____ (填“是"或否“),判断的理由是____(要求写出推算过程)。
(2 ) 4000C时发生变化的化学方程式是_______。
(3) 将6000C时样品池中残留的固体隔绝空气冷却至室温,再向该固体中加入一定量的稀盐酸刚好完全溶解,用pH试纸测得所得溶液的PH=3,其原因是____(用离子方程式回答):向该溶液中滴加适量NaOH溶液生成红褐色沉淀,測得此时溶液中铁元索的离子浓度为4.0x10-11mol/L,则此时溶液的pH=_______(已知:Ksp[Fe(OH)2]=8.0×10-16,Ksp[Fe(OH)3]=4.0×10-38)
(4) 将15000C时样品池中残留的固体隔绝空气冷却后,用稀盐酸溶解得一棕黄色溶液。取少量该溶液滴加KSCN,溶液显红色;另取少量该溶液滴加K3[Fe(CN)6)(铁氰化钾)溶液,产生特征蓝色沉淀。试写出图中14000C时发生反应的化学方程式_________ ,产生特征蓝色沉淀的离子反应方程式______。
参考答案:(1)是(2分)(2)FeC2O4 FeO+CO↑+CO2↑(2分)
FeO+CO↑+CO2↑(2分)
(3)Fe3++3OH- Fe(OH)3+3H+(2分) ; 5(2分) (4)6Fe2O3
Fe(OH)3+3H+(2分) ; 5(2分) (4)6Fe2O3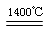 4Fe3O4+O2↑(2分);
4Fe3O4+O2↑(2分);
3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓或K++Fe2++[Fe(CN)6]3-=KFe[Fe(CN)6]↓(2分)
本题解析:(1)样品分解的方程式是
FeC2O4·2H2O FeC2O4·(2-n)H2O+nH2O
FeC2O4·(2-n)H2O+nH2O
180g?18n
1.000g?(1.000g-0.800g)
解得n=2,所以样品已经完全分解
(2)400℃时固体又减少了0.800g-0.400g=0.400g
根据铁原子守恒可知,400℃铁的含量应该是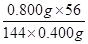 =
=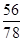 ,因此该化合物是氧化亚铁,其化学式是FeO,所以反应的化学方程式是FeC2O4
,因此该化合物是氧化亚铁,其化学式是FeO,所以反应的化学方程式是FeC2O4 FeO+CO↑+CO2↑。
FeO+CO↑+CO2↑。
(3)600℃样品中铁元素的含量是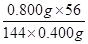 =0.70,因此该固体是氧化铁。氧化铁溶于盐酸生成氯化铁,铁离子水解溶液显酸性,其离子方程式是Fe3++3OH-
=0.70,因此该固体是氧化铁。氧化铁溶于盐酸生成氯化铁,铁离子水解溶液显酸性,其离子方程式是Fe3++3OH- Fe(OH)3+3H+。根据氢氧化铁的溶度积常数可知,当溶液中铁离子的离子浓度为4.0x10-11mol/L时,溶液中c(OH-)=
Fe(OH)3+3H+。根据氢氧化铁的溶度积常数可知,当溶液中铁离子的离子浓度为4.0x10-11mol/L时,溶液中c(OH-)=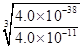 =10-9mol/L,所以溶液中c(H+)=10-5mol/L,因此pH=5。
=10-9mol/L,所以溶液中c(H+)=10-5mol/L,因此pH=5。
(4)另取少量该溶液滴加K3[Fe(CN)6)(铁氰化钾)溶液,产生特征蓝色沉淀,这说明溶液中还有亚铁离子生成。因此1400℃时氧化铁分解生成了四氧化三铁,反应的化学方程式是6Fe2O3 4Fe3O4+O2↑;产生特征蓝色沉淀的离子反应方程式3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓或K++Fe2++[Fe(CN)6]3-=KFe[Fe(CN)6]↓。
4Fe3O4+O2↑;产生特征蓝色沉淀的离子反应方程式3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓或K++Fe2++[Fe(CN)6]3-=KFe[Fe(CN)6]↓。
本题难度:一般
5、简答题
硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义.利用硫铁矿烧渣制备铁红等产品的实验流程如下:
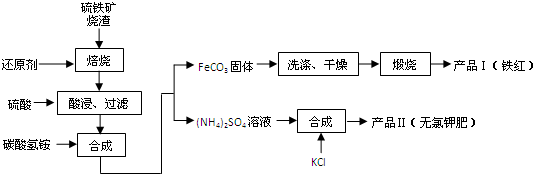
已知几种盐的溶解度随温度变化的曲线如下图所示:
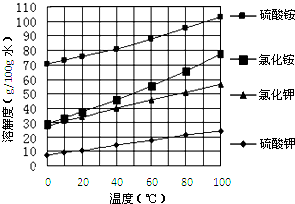
回答下列问题:
(1)酸浸、过滤后滤液中的金属阳离子是______.
(2)煅烧FeCO3生成产品I的化学反应方程式为______.实验室进行煅烧操作所需仪器除了酒精灯、泥三角、三脚架、玻璃棒外,还有______.
(3)产品Ⅱ的化学式为______,为了获得产品Ⅱ,向(NH4)2SO4溶液中加入KCl溶液后,还需要进行的操作是:______.
(4)检验产品II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液,______.
参考答案:(1)因Fe2O3、Fe3O4、FeO与还原剂反应生成铁,铁和稀硫酸反应生成硫酸亚铁和氢气,所以滤液中的主要溶质是硫酸亚铁,故答案为:Fe2+;
(2)因碳酸亚铁与氧气反应生成了氧化铁盒二氧化碳,4FeCO3+O2?高温?.?2Fe2O3+4CO2;因实验室进行煅烧操作所需仪器有酒精灯、泥三角、三脚架、玻璃棒、坩埚、坩埚钳,
故答案为:4FeCO3+O2?高温?.?2Fe2O3+4CO2;?坩埚、坩埚钳;
(3)硫酸铵与氯化钾反应生成硫酸钾和氯化铵;因硫酸钾的溶解度随温度变化不大,可用蒸发结晶、趁热过滤、洗涤、干燥得到硫酸钾,
故答案为:K2SO4;蒸发结晶、趁热过滤、洗涤、干燥;
(4)因检验产品II中是否含有氯化物杂质需先除去SO4,再检验Cl-,所以滴加过量Ba(NO3)2溶液,过滤后向滤液滴加AgNO3溶液,
故答案为:滴加过量Ba(NO3)2溶液,过滤后向滤液滴加AgNO3溶液.
本题解析:
本题难度:一般