|
高中化学知识点讲解《气体的净化、干燥、吸收与收集》试题巩固(2017年最新版)(十)
2017-03-02 23:08:24
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某一元醇A10g跟乙酸反应,生成乙酸某酯11.17g,反应后回收A 1.8g,A的相对分子质量接近于(?)
A.88
B.102
C.116
D.196
参考答案:C
本题解析:设醇A为R′—OH,其烃基部分的式量为R′,根据题意列式,求醇通式中的n值。
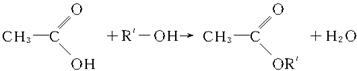
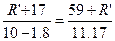 ? R′=99 ? R′=99
M(CnH2n+1)=99,n=7所以该醇化学式为C7H16O,M(C7H16O)=116
本题难度:简单
2、填空题 锌钡白是一种白色颜料。工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4=ZnS↓+BaSO4↓。请根据以下工业生产流程回答有关问题。
I.ZnSO4溶液的制备与提纯:
有关资料:a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2;
 ? ?
(1)滤渣1的化学式为?;②中使用的氧化剂最好是下列的?(填序号)。
A.Cl2
B.H2O2
C.KMnO4
D.浓HNO3
| (2)滤渣2中主要成分的化学式为?;为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤?(选填①、②、③、⑤)。
(3)步骤④发生的离子反应方程式为?。
II.BaS溶液的制备

有关数据:Ba(s)+S(s)+2O2(g)=BaSO4(s) △H1 = -1473.2 kJ?mol-1
C(s)+ 1/2O2(g)=CO(g)?△H2 = -110.5 kJ?mol-1
Ba(s)+ S(s)=BaS(s)?△H3 = -460 kJ?mol-1
(4)若煅烧还原的产物仅为BaS和CO,则其反应的热化学方程式为:
?。
Ⅲ.制取锌钡白
(5)如果Ⅰ中步骤⑤使用硫酸过量,产生的后果是?。
参考答案:(共16分)
(1)(4分)SiO2(2分)? B(2分)
(2)(3分)Fe(OH)3、Cu(OH)2(2分)?①(1分)
(3)(4分)OH-+CO2= HCO3-(2分)、ZnO22-+ 2CO2 + 2H2O = Zn(OH)2↓ + 2HCO3-(2分)
(4)(3分)BaSO4(s) + 4C(s) =" BaS(s)" + 4CO(g)?△H =" +571.2" kJ?mol-1
(5)(2分)过量的酸与BaS溶液混合会产生有毒的H2S气体污染空气(1分),而且锌钡白的产率会降低(1分)
本题解析:(1)ZnCO3、FeCO3、Cu2(OH)2CO3都能溶于足量5mol/LH2SO4溶液,符合复分解反应发生的条件,生成ZnSO4、FeSO4、CuSO4、CO2气体、H2O,而SiO2则不溶于硫酸,则步骤①酸浸之后所得滤渣1的化学式为SiO2,滤液1的主要成分是ZnSO4、FeSO4、CuSO4、H2O;步骤②中用Cl2能氧化Fe2+,但会引入新的杂质(Clˉ、Cl2),且过量的氯气有毒,故A错误;H2O2能氧化Fe2+,还原产物是H2O,不会引入新杂质,且过量H2O2受热易分解为水和氧气,故B正确;KMnO4能氧化Fe2+,但是会引入新的杂质(K+、Mn2+、KMnO4),故C错误;浓HNO3能氧化Fe2+,还原产物是有毒的NO2,且能引入新的杂质(NO3ˉ、HNO3),故D错误;(2)步骤②氧化后所得溶液的主要成分是ZnSO4、Fe2(SO4)3、CuSO4,都能与过量NaOH溶液反应,根据题意可知滤液2的主要成分是Na2ZnO2、NaOH,滤渣2的主要成分是Fe(OH)3、Cu(OH)2;步骤④中的CO2气体来自步骤①酸浸反应放出的气体,可以节能减排;(3)偏铝酸钠溶液通入过量CO2气体可以制氢氧化铝沉淀,由此推断步骤④发生的反应为Na2ZnO2、NaOH溶液分别与CO2气体的反应,NaOH+CO2=NaHCO3,Na2ZnO2+2H2O+2CO2=Zn(OH)2↓+2NaHCO3,则滤渣3为Zn(OH)2,滤液3的主要成分为NaHCO3;(4)根据盖斯定律,由②×4+③-①可以约去Ba(s)、S(s)、2O2(g),得到的热化学方程式为:BaSO4(s) + 4C(s) =" BaS(s)" + 4CO(g)?△H =" +571.2" kJ?mol-1;(5)若步骤⑤为Zn(OH)2与过量硫酸的中和反应,所得溶液的主要成分为ZnSO4、H2SO4,ZnSO4、H2SO4溶液与BaS(s)混合时不仅可以制取锌钡白,而且过量的H2SO4与易与BaS(s)发生复分解反应,生成有毒的H2S气体,既导致空气污染,又减少锌钡白的产量。
本题难度:一般
3、选择题 如右图装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体。该装置可用于
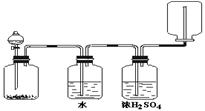
A.浓硝酸和铜反应制备NO2
B.浓氨水和生石灰反应制备氨气
C.锌和盐酸反应制备氢气
D.碳酸钙和盐酸反应制备二氧化碳
参考答案:C
本题解析:NO2溶于水与水反应,不能通入水中。氨气极易溶于水,也不能通入水中,更不能用浓硫酸干燥。CO2的收集应用向上排气法,所以正确的答案是C。
本题难度:简单
4、实验题 (13分)乙醇在实验中用途广泛。
(1)下图为实验室用乙醇制取乙烯并与溴水作用制取1,2—二溴乙烷的部分装置图,
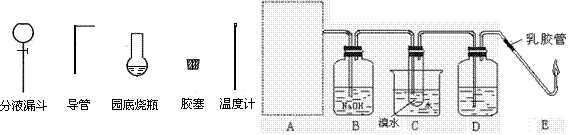
①请选用左图实验仪 器示意图在方框内画出乙烯的发生装置(夹持装置不必画出,需要加热的仪器下方用△标出)。 器示意图在方框内画出乙烯的发生装置(夹持装置不必画出,需要加热的仪器下方用△标出)。
②B和D装置都盛有NaOH溶液,它们的作用是:B? ____? __、D_________________。
③试写出以乙醇、浓硫酸、溴水为主要原料制取1,2—二溴乙烷的主要化学反应方程式。
_________________________________________________
_________________________________________________
④实验室用E图装置点燃乙烯,燃烧时 会产生黑烟,实验时若要迅速熄灭火焰,最简单、安全的操作方法是:?。 会产生黑烟,实验时若要迅速熄灭火焰,最简单、安全的操作方法是:?。
(2)实验室可用C2H518OH和乙酸按图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)
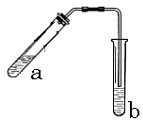
请填空:
①写 出实验室制乙酸乙酯的化学方程式(要标出氧-18示踪原子) 出实验室制乙酸乙酯的化学方程式(要标出氧-18示踪原子)
_______________________________________________________
②实验中加热试管的目的是:?
③试管b中加有饱和Na2CO3溶液,其作用是?
④反应结束后,振荡试管b静置,观察到的现象是?
参考答案:(13分)(1)①图略(2分)(温度计没插在液面下扣1分)
②B:除SO2、CO2等酸性气体;(1分)? D:尾气处理(1分)
③C2H5OH CH2=CH2+H2O;(1分)? CH2=CH2+Br2→CH2Br-CH2Br(1分) CH2=CH2+H2O;(1分)? CH2=CH2+Br2→CH2Br-CH2Br(1分)
④用手指把连接导气管的乳胶管捏瘪一下,火焰自动熄灭。(1分)。
(2)①CH3COOH+C2H518OH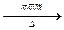 CH3CO18OC2H5+H2O(2分) CH3CO18OC2H5+H2O(2分)
②加快反应速率;及 时将产物乙酸乙酯蒸出,以利于平衡向生成乙酸乙酯的方向移动(2分) 时将产物乙酸乙酯蒸出,以利于平衡向生成乙酸乙酯的方向移动(2分)
③吸收随乙酸乙酯蒸出的少量酸性物质和乙醇(1分)
④b中的液体分层,上层是透明的油状液体? 1分)
本题解析:略
本题难度:一般
5、实验题 (12分)碱式碳酸铜可表示为:xCuCO3·yCu(OH) 2·zH2O,测定碱式碳酸铜组成的方法有多种。
(1)现采用氢气还原法,请回答如下问题:
①写出xCuCO3·yCu(OH) 2·zH2O与氢气反应的化学方程式?
?;
②试验装置用下列所有仪器连接而成,其中D、E可重复使用。按氢气流方向的连接顺序是(填入各仪器相应字母,如果认为必要可以补充):
A→(?)→(?)→(?)→(?)→(?)? →F
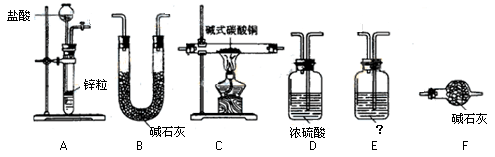
③E装置的作用是___________________,E中的药品最好是______________
A.水? B.饱和碳酸钠溶液? C.饱和碳酸氢钠溶液? D.氢氧化钠溶液
④称取23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为??g,化学式为?;
(2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?_______(填“可行”或“不可行”)如果可行写出反应的化学方程式:(认为不可行此空可不填)?。
参考答案:(12分)
⑴① xCuCO3·yCu(OH)2·zH2O+(x+y)H 2 =" (x+y)Cu+" xCO2+(x+2y+z)H2O(2分)
 ② A EDCDB F(2分)?③A(1分)?④1.8? CuCO3·Cu(OH) 2·H2O(4分) ② A EDCDB F(2分)?③A(1分)?④1.8? CuCO3·Cu(OH) 2·H2O(4分)
⑵ ?可行? xCuCO3·yCu(OH) 2·zH2O="(x+y)CuO+" xCO2↑+(y+z)H2O↑(3分) ?可行? xCuCO3·yCu(OH) 2·zH2O="(x+y)CuO+" xCO2↑+(y+z)H2O↑(3分)
本题解析:略
本题难度:简单
| 