微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (14分)某学校探究性学习小组对消毒液次氯酸钠(NaClO)的制备与性质等进行了探究。
甲同学:为制备消毒液,探究并制作了一种家用环保型消毒液(NaClO溶液)发生器,设计了如图所示的装置,用石墨作电极电解饱和氯化钠溶液。
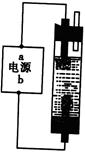
请完成下列问题:若通电时,为使生成的Cl2被完全吸收,制得有较强杀菌能力的消毒液,则电源的a电极名称为?极(填“正”、“负”、“阴”或“阳”);装置溶液中反应生成NaClO的离子方程式为:?。
乙同学:从某超市中查询到某品牌消毒液包装说明的部分内容,摘录如下:
主要有效成份为次氯酸钠,有效氯含量8000-10000mg/L。可用于各类家居用品、餐具、棉织衣物等的消毒,对彩色织物可能有褪色作用。切勿用于丝绸、毛、尼龙、皮革、油漆表面,勿用于铝、铜、碳钢制品。本品须密封,置阴凉暗处保存。
请完成以下实验探究过程:
I.阅读材料,根据学过的知识判断问题?
(1)室温条件下,该消毒液(NaClO)的不显中性的原因是(用离子方程式表示)
_____________________。
(2)该消毒液还具有的化学性质是_________(填序号)。
A.强氧化性? B.强还原性? C.不稳定性? D.漂白性? E.弱酸性
(3)从该消毒液的保存要求分析,导致其失效的主要原因是(用化学方程式表示)
_?。
II.确定要研究的问题
该消毒液对碳钢制品的腐蚀原理。
III.设计方案,实施探究
(1)用烧杯取少量样品,将一颗光亮的普通碳钢钉放入烧杯,浸泡一段时间。
预期的实验现象是_________________________________。
(2)为了进一步探究铁钉在该漂白剂(NaClO)溶液中的腐蚀原理,丁同学设计了如下图实验装置,写出碳(C)极上发生的电极反应式:?。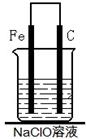
参考答案:甲:负(1分)Cl2+2OH-===Cl-+ClO-+H2O(2分)
乙:I.(1)ClO-+H2O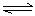 HClO+OH- (2分)
HClO+OH- (2分)
(2)A、D(2分)2NaClO+CO2+H2O=Na2CO3+2HClO(2分)? 2HClO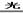 2HCl+O2↑(2分)
2HCl+O2↑(2分)
III.(1)钢钉表面有红褐色物质生成(2分)
(2)ClO-+2e-+H2O=Cl-+2OH-(2分)
本题解析:电解NaCl溶液生成氢氧化钠、氢气和氯气,氯气与氢氧化钠反应生成次氯酸钠,次氯酸钠因为水解显碱性。次氯酸钠具有强氧化性和漂白性。如果接触到空气中CO2,就会生成HClO,HClO分解就会使消毒液失效。将碳钢铁钉浸在次氯酸钠中,会发生电化学腐蚀。其中铁为负极,碳为正极。铁失电子,因为次氯酸根离子的强氧化性,次氯酸根离子得电子生成Cl—。
本题难度:简单
2、选择题 实验室里可按图所示的装置来干燥、收集气体R,多余的气体R可用水吸收,则R是
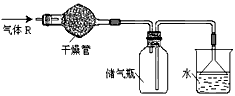
[? ]
A.HCl
B.Cl2
C.CO
D.NH3
参考答案:D
本题解析:
本题难度:简单
3、实验题 (13分)某研究性学习小组利用如图所示装置完成有关实验。

【实验一】快速制氨气
(1)用装置I快速制氨气,则装置I的a仪器中可加入浓氨水,b仪器中加入?。装置Ⅱ从?管口进气可作为氨气的收集装置。实验过程中,使用分液漏斗滴加液体的操作是?。
(2)该实验剩余的NH3需吸收处理。以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有?
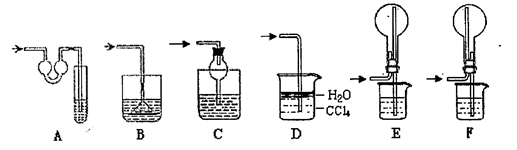
(3)实验中若需用所给装置量取NH3的体积,试简述操作方法
?
所装液体最好是____(填字母编号)
a.浓NaOH溶液? b.氨水? c.煤油? d.氯化铵溶液
本实验应对量气装置多次读数,读数时应注意:①将实验装置恢复到室温,②?,③视线与凹液面最低处相平。
【实验二】比较盐酸、碳酸、硅酸的酸性强弱(可以不填满,也可以再加行)
(4)用所给装置设计实验,完成下列表格
装 置序号 置序号
| 仪器中所加物质名称
| 目的或现象
|
?
| ?
| ?
|
?
| ?
| ?
|
?
| ?
| ?
参考答案:(13分)(1)生石灰(或氢氧化钠固体)(1分)? d(1分)
打开分液漏斗上口的活塞(或将活塞上的凹槽与瓶口上的小孔对齐),旋开分液漏斗的旋塞,缓慢滴加。(2分)
(2)ACDF (2分,答对2~3个得1分,答对4个得2分,有错误答案即得0分)
(3)将广口瓶Ⅱ中装满液体,连接cf,NH3从d管通入(2分)? c(1分)使量筒与广口瓶液面相平(1分)
(4) (3分)
装置序号
仪器中所加物质名称
目的或现象
Ⅰ
稀盐酸、碳酸钠固体
固体溶解有气泡产生
Ⅱ
饱和NaCl溶液
吸收CO2中的HCl
Ⅲ
硅酸钠溶液
有白色胶状沉淀出现
本题解析:略
本题难度:一般
4、填空题 (12分)过氧化氢是一种重要的化学产品,在工农业生产和日常生活中有着广泛应用,工业采用烷基薏醌法生产

根据生产过氧化氢原理和工艺,回答下列问题:
(1)该生产过氧化氢的原理中,原子利用率为?。
(2)该工艺中有机溶剂为液态烷烃和酯类,能否用乙醇代替??
(3)为了提高经济效益,该工艺氢化反应,除了加催化剂外,还可采取的措施是?。
A.适当加热? B.加压? C.增大工作液中有机溶剂的量
(4)该工艺中“后处理”的目的是?。
(5)该工艺中由35%的H2O2得到70%的H2O2可采取操作方法是?。
(6)硫酸酸化的过氧化氢溶液可溶解金属铜,试写出该反应的离子方程式为?。
参考答案:每空均2分
(1)100%
(2)否,因为乙醇与过氧化氢溶液及烷基蒽醌 等都互溶,无法萃取,难于与工作液分离(判断正确即可得2分) 等都互溶,无法萃取,难于与工作液分离(判断正确即可得2分)
(3)AB(错选不得分,漏选得1分)
(4)回收RAQ(及HRAQ)及有机溶剂并循环使用。
(5)减压蒸馏(填:蒸馏得1分)
(6)Cu+2H++H2O2=Cu2++2H2O
本题解析:略
本题难度:简单
5、实验题 (19分)黄铜矿的主要成分是CuFeS2(硫元素显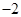 价,铁元素显+2价)。实验室里用黄铜矿为原料制取单质铜和铁红(Fe2O3)的流程如下: 价,铁元素显+2价)。实验室里用黄铜矿为原料制取单质铜和铁红(Fe2O3)的流程如下:
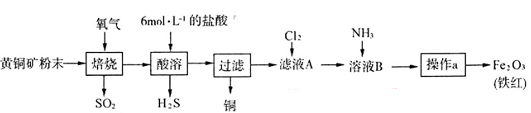
已知:
 ? ? = =
(1)在实验室中,应将黄铜矿粉末放在__________(填仪器名称)中焙烧。
(2)将反应过程中产生的SO2和H2S通入下图所示装置中检验它们的性质。该实验证明SO2具有_________性和__________性。
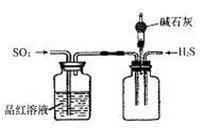
(3)欲选用下列部分装置在实验室中以MnO2和浓盐酸为原料制取纯净、干燥的氯气。
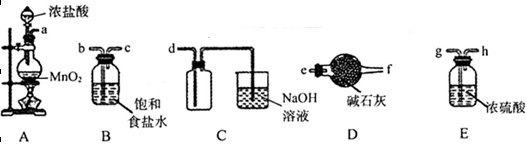
①圆底烧瓶中发生反应的离子方程式为_________________________________________。
②按气流方向由左到右,导管口连接顺序为a→__________________________________。
③装置连接好后,在装药品前,需检验装置的气密性,具体方法是__________________。
④向滤液A中通入C12,某同学取通入C12后的溶液滴加KSCN溶液,用来证明C12的氧化性比Fe3+强的结论。该实验设计是否合理________(填“是”或“否”),请用简要文字解释你的理由_____________________________________________________________。
(4)若使用20 g黄铜矿粉末可制得8 gFe2O3(铁红),则该黄铜矿中含CuFeS2的质量分数是________ (假设各步反应均完全进行且过程中无额外物质损耗)。
参考答案:(19分)
(1)坩埚(2分)
(2)漂白(2分);氧化(2分)
(3)①MnO2+4H++2Cl? Mn2++Cl2↑2H2O(3分)②b→c→g→h→d(2分) Mn2++Cl2↑2H2O(3分)②b→c→g→h→d(2分)
③关闭分液漏斗的活塞,将导管插入水中,微热圆底烧瓶,若导管末端产生气泡,停止加热,导管中有一段水柱形成,说明装置不漏气。(3分)
④否(1分),在通氯气前滤液A中就可能含有Fe3+,无法确定Fe3+一定是Fe2+被Cl2氧化得来的。(2分)
(4)92%(2分)
本题解析:(1)固体的焙烧在坩埚内进行。
(2)SO2通入品红溶液,证明SO2具有漂白性;SO2通入H2S溶液,生成S淡黄色沉淀,证明SO2具有氧化性。
(3)①MnO2与浓盐酸反应生成Cl2、MnCl2、H2O。离子方程式为:MnO2+4H++2Cl? Mn2++Cl2↑2H2O Mn2++Cl2↑2H2O
②生成的Cl2含有HCl、H2O,所以a连接b、c,通过饱和食盐水除去HCl、继续连接g、h,通过浓硫酸,除去H2O,再连接d,即可收集纯净、干燥的氯气。
③利用加热气体膨胀的原理进行装置气密性的检验,所以检验方法为:关闭分液漏斗的活塞,将导管插入水中,微热圆底烧瓶,若导管末端产生气泡,停止加热,导管中有一段水柱形成,说明装置不漏气。
④因为该检验方法是先通入氯气,再滴加KSCN溶液,在通氯气前滤液A中就可能含有Fe3+,无法确定Fe3+一定是Fe2+被Cl2氧化得来的,所以该实验设计不合理。
(4)根据Fe元素守恒可得:2CuFeS2~ Fe2O3,所以该黄铜矿中含CuFeS2的质量分数=8g×368/160÷20g×100%=92%
本题难度:一般
|