|
高中化学知识点讲解《气体的净化、干燥、吸收与收集》试题巩固(2017年最新版)(六)
2017-03-02 23:08:24
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的气态氢化物具有相同的电子数,X元素的最外层电子数是次外层电子数的三倍。
(1)写出实验室制取W2的离子方程式?;
(2)某小组设计如图所示的实验装置图(图中夹持和加热装置略去),分别研究YX2和W2 的性质。
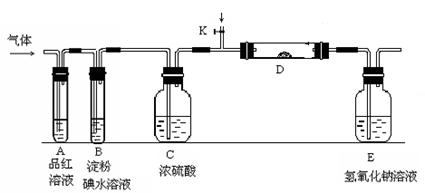
①分别通入YX2和W2 时,在装置A中观察到的现象是否相同(填“相同”或“不相同”)?。
装置D中装的是五氧化二钒,当通入YX2时,打开K放入适量的氧气,在D装置中发生化学反应方程式为?,
②若装置B中装有5.0 mL 1.0×10-3 mol/L的碘水,当通入足量W 91ExAm.org2完全反应后,转移了5.0×10-5 mol电子,该反应的化学方程式为?。
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,向该试管中加入适量(填字母)?,可以看到白色沉淀产生。
A.氨水
B.稀盐酸
C.稀硝酸
D.氯化钙
参考答案:(1)制取氯气的离子方程式
(2)相同? SO2→SO3? 5Cl2+I2+6H2O=10HCl+2HIO3
(3)A C
本题解析:略
本题难度:简单
2、简答题 (12分)以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下:
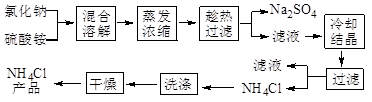
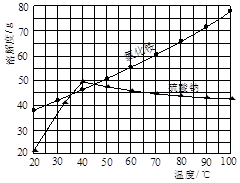
氯化铵和硫酸钠的溶解度随温度变化如上图所示。回答下列问题:
(1)写出制备 NH4Cl的化学方程式:?。
(2)实验室进行蒸发浓缩用到的主要仪器有?、带铁圈的铁架台、玻璃棒、酒精灯等。
(3)实验过程中趁热过滤的目的是?。冷却结晶后的过滤采用抽滤,其装置如图1所示,请指出该装置中的错误之处?;
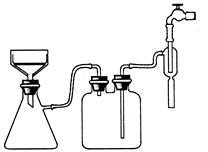 ? ?
图1?图2
(4)趁热过滤后,滤液冷却结晶。一般情况下,下列哪些因素有利于得到较大的晶体?。
A.缓慢冷却溶液
B.溶液浓度较高
C.溶质溶解度较小
D.缓慢蒸发溶剂
| (5)为定粗产品的含氮量,称取11.2gNH4Cl粗产品,用图2装置进行实验,充分反应后,测得B装置增重3.4g。则该粗产品中含氮的质量分数为?。
参考答案:(1)?(NH4)2SO4+2NaCl ===2NH4Cl↓+ Na2SO4?(2)蒸发皿?
(3)防止温度降低,氯化铵晶体析出而损失、布氏漏斗的颈口斜面未与吸滤瓶的支管口相对
(4) AD?(5)? 25%
本题解析:(1)根据反应物和生成物可知,方程式为(NH4)2SO4+2NaCl ===2NH4Cl↓+ Na2SO4。
(2)蒸发浓缩用到的主要仪器是蒸发皿。
(3)由于温度降低,会析出晶体,所以为防止温度降低氯化铵晶体析出而损失,需要趁热过滤。根据装置可判断,错误之处在于布氏漏斗的颈口斜面未与吸滤瓶的支管口相对。
(4)溶液浓度较高或溶质溶解度太小,都不利于得到较大的晶体,答案选AD。
(5)B装置增重3.4g,则生成氨气是3.4g,其物质的量是3.4g÷17g/mol=0.2mol,因此该粗产品中含氮的质量分数为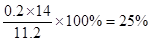 。 。
本题难度:一般
3、填空题 (12分)过氧化钙晶体[CaO2·8H2O]较稳定,呈白色,微溶于水,能溶于酸性溶液。广泛应用于环境杀菌、消毒等领域。
Ⅰ.过氧化钙晶体的制备
工业上生产CaO2·8H2O的主要流程如下:
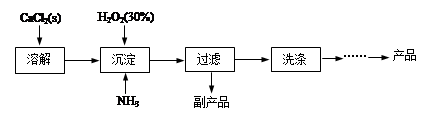 
(1)用上述方法制取CaO2·8H2O的化学方程式是?。
(2)沉淀时常用冰水控制温度在10℃以下,其可能原因分别是?。
Ⅱ.过氧化钙晶体含量的测定
准确称取0.3000g产品于锥形瓶中,加入30 mL蒸馏水和10 mL 2.000 mol·L-1 H2SO4,用0.0200 mol·L—1KMnO4标准溶液滴定至终点。重复上述操作两次。H2O2和KMnO4反应的离子方程式为2MnO4-+5 H2O2+6H+ =2Mn2++5O2↑+8H2O
(3)滴定终点观察到的现象为???。
(4)根据表1数据,计算产品中CaO2·8H2O的质量分数(写出计算过程)
滴定次数
| 样品的质量/g
| KMnO4溶液的体积/mL
| 滴定前刻度/mL
| 滴定后刻度/mL
| 1
| 0.3000
| 1.02
| 24.04
| 2
| 0.3000
| 2.00
| 25.03
| 3
| 0.3000
| 0.20
| 23.24
|
?
参考答案:(1)CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4Cl (2分)
(2)①温度低可减少过氧化氢的分解,提高过氧化氢的利用率(或防止过氧化氢的分解)(2分)
(3)当滴入最后一滴KMnO4标准溶液后溶液由无色变浅红色,且30s不褪色(2分)
(4)82.91%
5(CaO2·8H2O)~5H2O2~2KMnO4(1分)
n(CaO2·8H2O)=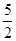 n(KMnO4) n(KMnO4)
=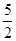 ×0.0200 mol·L—1×23.03mL×10—3L·mL—1(1分) ×0.0200 mol·L—1×23.03mL×10—3L·mL—1(1分)
=1.151×10—3 mol(1分)
CaO2·8H2O的质量分数为: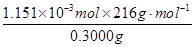 ×100%=82.91%(1分) ×100%=82.91%(1分)
本题解析:(1)写化学方程式要从反应物和生成物入手,先确定是否是氧化还原反应,从流程是看出反应物是CaCl2、H2O2和NH3,生物是CaO2·8H2O,根据质量守恒定律可知另一种生物是NH4Cl,在这个反应中元素化合价没有发生变化,所以不是氧化还原反应,先写出CaCl2+H2O2+NH3——CaO2·8H2O↓+NH4Cl,再根据观察法进行配平,最后确定反应物还需要水参加反应。
(2)题目提供的条件是冰水控制温度在10℃以下,首先容易想到的是减少过氧化氢的分解。
(3)根据酸碱滴定原理,利用酸碱指示剂变色来确定滴定终点,本题是用酸性KMnO4来氧化H2O2,因为紫红色KMnO4溶液作氧化剂,会被还原成无色的Mn2+,所以不需要另加酸碱指示剂来确定滴定终点,当滴入最后一滴KMnO4标准溶液后溶液由无色变浅红色,且30s不褪色时,即可认定到达滴定终点。
(4)多步反应计算的特征是化学反应原理中多个反应连续发生,起始物与目标物之间存在确定的量的关系。解题时应先写出有关反应的化学方程式或关系式,依据方程式找出连续反应的过程中不同反应步骤之间反应物、生成物物质的量的关系,最后确定已知物和目标产物之间的物质的量的关系,列出计算式求解,从而简化运算过程。
根据表格1所提供的数据,首先要算出三次滴定消耗的KMnO4的平均值为23.03mL,
2MnO4-+5 H2O2+6H+ =2Mn2++5O2↑+8H2O
CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4Cl
再根据这两个方程式得出MnO4-与CaO2·8H2O的关系,
n(CaO2·8H2O)=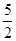 n(KMnO4) n(KMnO4)
=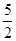 ×0.0200 mol·L—1×23.03mL×10—3L·mL—1(1分) ×0.0200 mol·L—1×23.03mL×10—3L·mL—1(1分)
=1.151×10—3 mol(1分)
CaO2·8H2O的质量分数为: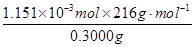 ×100%=82.91% ×100%=82.91%
本题难度:一般
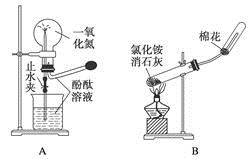
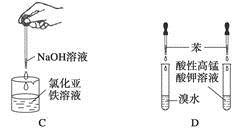
4、选择题 下列药品和装置合理且能完成相应实验的是?
A.喷泉实验
B.实验室制取并收集氨气
C.制备氢氧化亚铁
D.验证苯中是否有碳碳双键
参考答案:D
本题解析:NO不溶于水,也不与水反应,故不能用于喷泉实验,A项错误;加热固体混合物时,试管口应略向下倾斜,B项错误;Fe(OH)2具有较强的还原性,应将滴管插入液面以下,C项错误;通过溴水或酸性高锰酸钾溶液是否褪色,可以验证苯环中是否有碳碳双键,D项正确。
本题难度:一般
5、选择题 用氢氧化钠固体配制0.10mol/L的氢氧化钠溶液,下列说法错误的是
A.定容时俯视,会造成浓度偏高
B.转移时不慎将转移液溅出,会造成浓度偏低
C.称量时托盘上要垫上干净的称量纸
D.定容摇匀后发现液面下降,不应继续加水
参考答案:C
本题解析:C项:氢氧化钠易潮解,会留在纸上,应在烧杯中称量,故错。故选C。
点评:本题考查的是配置配置一定物质的量浓度的知识,难度不大,注意基础知识的掌握和应用。
本题难度:简单
|