微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列操作不能用于检验NH3的是
A.气体使湿润的酚酞试液变红
B.气体能使湿润的红色石蕊试纸变蓝
C.气体与蘸有浓H2SO4的玻璃棒靠近
D.气体与蘸有浓盐酸的玻璃棒靠近
参考答案:C
本题解析:略
本题难度:简单
2、实验题 某化学小组同学利用以下药品及装置制取氨气并研究其性质(部分仪器已略去)
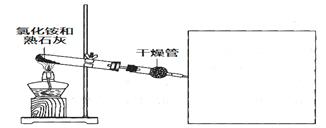
请回答:
(1)制备氨气的化学方程式是________________。
(2)干燥氨气可选用的试剂是________(填选项)。
a. 浓硫酸? b. 碱石灰? c. 氢氧化钠溶液
(3)在方框内绘制用小试管收集氨气的装置图。
(4)在实验室中检验氨气可选用________石蕊试纸。也可用玻璃棒蘸取浓盐酸,若观察到________________(填现象),即可证明,该反应的化学方程式是
________________________________________________________________________
参考答案:(8分)(1)2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O(2分)
CaCl2+2NH3↑+2H2O(2分)
(2)b(1分)(3) (1分,没画棉花不扣分)
(1分,没画棉花不扣分)
(4)湿润的红色(1分)?产生白色的烟(1分)?NH3+HCl=NH4Cl(2分)
本题解析:(1)实验室用熟石灰和氯化铵加热制备氨气,则制备氨气的化学方程式是2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。
(2)氨气是碱性气体,极易溶于水,不能用浓硫酸和氢氧化钠溶液干燥,选择的干燥剂是碱石灰,答案选b。
(3)氨气极易溶于水,不能用排水法收集。又因为氨气的密度小于空气的,所以应该用向下排空气法收集。为防止与空气形成对流,需要在试管口塞一团棉花。
(4)氨气是碱性气体,溶于水显碱性,可用湿润的红色石蕊试纸检验。另外氨气能和氯化氢反应生成氯化铵,而冒白烟,所以还可用玻璃棒蘸取浓盐酸,若观察到产生白色的烟,即可证明,该反应的化学方程式是NH3+HCl=NH4Cl。
点评:该题是基础性试题的考查,试题紧扣教材基础,有利于调动学生的学习兴趣,提高学生的学习效率。该题的关键是明确氨气的性质以及制备原理,然后结合题意和装置图灵活运用即可。
本题难度:一般
3、简答题 1898年,曾有人发明了固氮的一种方法,该法以石灰石、焦炭、空气为原料。第一步反应是石灰石分解;第二步是使第一步反应产物和焦炭反应,在电炉中的高温下制得第三步反应起始物;第三步反应中另一反应物是空气,该反应也是在电炉中完成的,生成一种固体;第四步是使该固体和水蒸气反应制得氨气。又知该固体中有与N3-互为等电子体的离子。(1)试写出四步反应的化学方程式;
(2)试简评该固氮方法。
参考答案:(1)CaCO3 CaO+CO2↑; CaO+3C
CaO+CO2↑; CaO+3C CaC2+CO↑;CaC2+N2
CaC2+CO↑;CaC2+N2 CaCN2+C ;? CaCN2+3H2O(g)=CaCO3+2NH3↑。
CaCN2+C ;? CaCN2+3H2O(g)=CaCO3+2NH3↑。
(2)这种方法,需要消耗大量电能,原料众多,设备重,生产成本高。
本题解析:前二步反应分别是石灰石的分解和制造电石的反应:
CaCO3 CaO+CO2↑;? CaO+3C
CaO+CO2↑;? CaO+3C CaC2+CO↑
CaC2+CO↑
第三步反应是CaC2在高温下与空气中的氮气反应,以取得固氮的效果。由于生成物与N3-互为等电子体的离子,氮元素在此生成物中应为-3价,后者与水反应才更有可能生成NH3。N3-的等电子体有CN22-、C2N3-。如果N为-3价,在CN22-中C为+4价,在C2N3-中C为0价,不合理,因此生成物中的该离子只能为CN22-。其化学方程式为:
CaC2+N2 CaCN2+C ;? CaCN2+3H2O=CaCO3+2NH3↑。
CaCN2+C ;? CaCN2+3H2O=CaCO3+2NH3↑。
这种方法较之现在的合成氨工业,需要消耗大量电能,原料众多,生产成本高,因此,很快被合成氨的催化法代替。
本题难度:一般
4、实验题 (共14分)某同学用下列装置(固定、加热仪器和橡胶管略)进行有关氨气制取 及其相关实验的探究,回答下列问题.
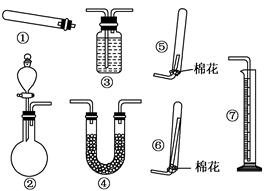
(1)若用装置①制取NH3,其反应的化学方程式为?;若要测定生成的NH3的体积,则必须选择的装置是?(填装置序号),装置中所盛试剂应具有的性质是?.
(2)若用装置②制取并收集干燥的NH3,收集装置应选择??(填装置序号).
(3)在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1—10nm之间)。
①向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是?,试写出制纳米级碳酸钙的离子方程式?;
②在浓CaCl2溶液和NH3用量正确的情况下,CO2不足或过量都会导致纳米级碳酸钙产量下降,若CO2过量溶液中大量存在的离子有(不考虑弱电解质的电离和盐类水解产生的少量离子)_____________________________。
参考答案:(每空2分,共14分)
(1)2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O、③⑦
2NH3↑+CaCl2+2H2O、③⑦
氨气难溶于该试剂,该试剂不易挥发,不与氨气反应。
(2)⑥
(3)①NH3、 Ca2++2NH3+H2O+CO2=CaCO3+2NH4+
②Ca2+?HCO3-?NH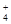 ? Cl-
? Cl-
本题解析:(1)实验室制取氨气的方程式是2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O。要测定生成的氨气体积,则需要通过排液法,因此装置中所盛放的液体必须满足氨气难溶于该试剂,该试剂不易挥发,且不与氨气反应。
2NH3↑+CaCl2+2H2O。要测定生成的氨气体积,则需要通过排液法,因此装置中所盛放的液体必须满足氨气难溶于该试剂,该试剂不易挥发,且不与氨气反应。
(2)氨气极易溶于水,但氨气的密度小于空气的,所以采用向下排空气法收集,即选择装置⑥。
(3)①由于CO2难溶于水,而氨气极易溶于水,所以首先通入的是氨气,钙反应的离子方程式是Ca2++2NH3+H2O+CO2=CaCO3+2NH4+。
②如果CO2过量,则生成碳酸氢钙,所以溶液中大量存在的离子是Ca2+、HCO3-、NH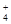 、Cl-。
、Cl-。
本题难度:一般
5、选择题 下列各组化合物中的氮元素,具有相同化合价的是?(?)
A.NO和NO2
B.NO2和N2O4
C.NH3和NH4Cl
D.N2O和HNO2
参考答案:BC
本题解析:略
本题难度:简单