微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 下图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化。实验时必须使用铁屑和6mol·L-1
的硫酸,其他试剂任选。填写下列空白
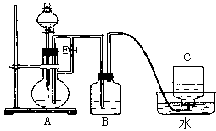
(1)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是______________。A中反应的离子方程式是
_______________________。
(2)实验开始时先应将活塞E________(填“打开”“关闭”或“无关系”),其目的是____________________________;C中收集到气体的主要成分是______________。
(3)待C中收集到足量气体后,生成Fe(OH)2的操作是______________。
(4)拔去装置B中的橡皮塞,使空气进入,反应的化学方程式是____________________________。
参考答案:(1)铁屑;Fe+2H+==Fe2++H2↑
(2)打开;排除B中的空气;H2
(3)关闭活塞E;使FeSO4溶液压入B中进行反应
(4)4Fe(OH)2+O2+2H2O==4Fe(OH)3
本题解析:
本题难度:一般
2、实验题 已知下列数据:
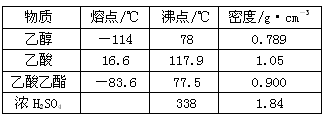
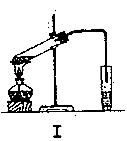

实验室制乙酸乙酯的主要装置如上图I所示,主要步骤为:①在30mL的大试管中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合液;②按照图I连接装置,使产生的蒸气经导管通到15mL试管所盛饱和Na2CO3溶液(加入1滴酚酞试液)上方2mm~3mm处,③小火加热试管中的混合液;④待小试管中收集约4mL产物时停止加热,撤出小试管并用力振荡,然后静置待其分层;⑤分离出纯净的乙酸乙酯。
请同学们回答下列问题:
(1)步骤①中,配制这一比例的混合液的操作是_________________________________。
(2)写出该反应的化学方程式_____________________________,浓H2SO4的作用是___________________________。
(3)步骤③中,用小火加热试管中的混合液,其原因与结论__________________________。
(4)步骤④所观察到的现象是_________,原因是________________________。
(5)步骤⑤中,分离出乙酸乙酯选用的仪器是_________,产物应从_________口倒出,因为__________________。
(6)为提高乙酸乙酯的产率,甲、乙两位同学分别设计了如上图甲、乙的装置(乙同学待反应完毕冷却后再用饱和Na2CO3溶液提取烧瓶中产物)。你认为哪种装置合理,为什么?答:_____________________________。
参考答案:(1)先加乙酸和乙醇各4mL,再缓缓加入1mL浓H2SO4,边加边振荡。
(2)方程式略;催化剂,吸水剂
(3)乙酸、乙醇、乙酸乙酯沸点接近且较低,大火加热,反应物大量蒸发损失
(4)在浅红色Na2CO3溶液上层有约4cm厚的无色液体,振荡后Na2CO3溶液层红色变浅,有气泡,上层液体变薄。
原因是:上层是油层因为生成的乙酸乙酯难溶于水,且密度比水小,同时因为挥发出来的乙酸与碳酸钠反应,放出CO2气体,所以有气泡出现
(5)分液漏斗;上;乙酸乙酯比水密度小
(6)乙,反应物能冷凝回流
本题解析:
本题难度:一般
3、实验题 高氯酸铵(NH4ClO4)是复合火箭推进剂的重要成分,实验室可通过下列反应制取
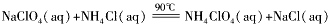
(1)若NH4Cl用氨气和浓盐酸代替,上述反应不需要外界供热就能进行,其原因是________________。
(2)反应得到的混合溶液中NH4ClO4和NaCl的质量分数分别为0.30和0.l5(相关物质的溶解度曲线见下图)。从混合溶液中获得较多NH4ClO4晶体的实验操作依次为(填操作名称)_____________干燥。

(3)样品中NH4ClO4的含量可用蒸馏法进行测定,蒸馏装置如图所示(加热和仪器固定装代已略去),实验步骤如下:
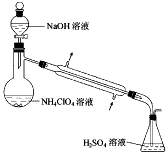
步骤1:按上图所示组装仪器,检查装置气密性。
步骤2:准确称取样品a g(约0.5g)于蒸馏烧瓶中,加入约150mL水溶解。
步骤3:准确量取40.00mL约0.1mol/L H2SO4溶解于锥形瓶中。
步骤4:经滴液漏斗向蒸馏瓶中加入20mL 3mol/LNaOH溶液。
步骤5:加热蒸馏至蒸馏烧瓶中神域约100mL溶液。
步骤6:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中。
步骤7:向锥形瓶中加入酸碱指示剂,用c mol/L NaOH标准溶液滴定至终点,消耗NaOH标准溶液V1mL。
步骤8:将实验步骤1-7重复2次
①步骤3中,准确量取40.00ml H2SO4溶液的玻璃仪器是________。
②步骤1-7中确保生成的氨被稀硫酸完全吸收的实验是_____(填写步骤号)。
③为获得样品中NH4ClO4的含量,还需补充的实验是_____________。
参考答案:(1)氨气与浓盐酸反应放出热量
(2)蒸发浓缩,冷却结晶,过滤,冰水洗涤
(3)①酸式滴定管;②1,5,6;③用NaOH标准溶液标定H2SO4溶液的浓度(或不加高氯酸铵样品,保持其他条件相同,进行蒸馏和滴定实验)
本题解析:
本题难度:困难
4、实验题 聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。现用一定质量的铁的氧化物(如下图)为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+。实验步骤如下:
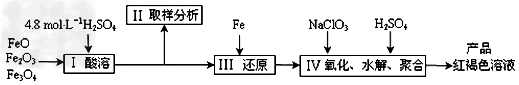
(1)实验室用18.4?mol·L-1的浓硫酸量取_______mL来配制250mL4.8?mol·L-1的硫酸溶液,所用的仪器除烧杯、玻璃棒和移液管外,还需要的玻璃仪器_____________。
(2)步骤II取样分析溶液中的Fe2+、Fe3+的含量,目的是_____________。
A.控制溶液中Fe2+与Fe3+含量比?
B.确定下一步还原所需铁的量
C.确定氧化Fe2+所需NaClO3的量?
D.确保铁的氧化物酸溶完全
(3)①写出步骤Ⅳ中用NaClO3氧化时的离子方程式____________________(提示:ClO3-转化为Cl-);
②已知1mol?HNO3的价格为0.16元,1mol?NaClO3的价格为0.45元,评价用HNO3代替NaClO3作为氧化剂的利弊,利是__________,弊是____________。
(4)为了分析产品聚合硫酸铁溶液中SO42-与Fe3+?物质的量之比,有人设计了以下操作
(a)取25mL聚合硫酸铁溶液,加入足量的BaCl2溶液,产生白色沉淀,白色沉淀经过过滤、洗涤、干燥后,称重,其质量为m?g。
(b)另取25mL聚合硫酸铁溶液,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250mL溶液,取该溶液25.00mL,用KMnO4酸性溶液滴定,到达终点时用去0.1000?mol/L?KMnO4标准溶液VmL。离子方程式为:5Fe2+?+?MnO4-+?8H+?=?5Fe3+?+?Mn2+?+?4H2O
①判断(a)步骤溶液中SO42-离子已沉淀完全的方法是__________________;?
②在(b)步骤中判断达到终点的现象是_______________;
③聚合硫酸铁中SO42-与Fe3+的物质的量之比为____________(用含m、V的代数式表示)。
参考答案:(1)65.2mL;250mL容量瓶、胶头滴管
(2)BC
(3)①6Fe2+ + ClO3- + 6H+ = 6Fe3+ + Cl- + 3H2O
②利:原料成本较低;弊:产生气体对大气有污染
(4)①取上层清夜,滴加BaCl2溶液,若无沉淀产生,则溶液中SO42-已沉淀完全;②溶液由浅蓝色变为浅紫红色,且半分钟内不变色;③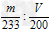
本题解析:
本题难度:一般
5、实验题 垃圾是放错地方的资源,工业废料也可以再利用。某化学兴趣小组在实验室中用废弃含有铝、铁、铜的合金制取硫酸铝溶液、硝酸铜晶体和铁红(Fe2O3)。其实验方案如下
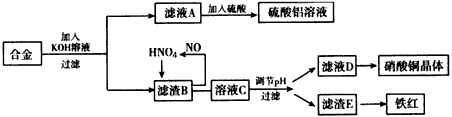
(1)请写出在合金中加入KOH溶液后所发生的离子反应方程式:____________________
(2)在滤液A中直接加入硫酸所获得的硫酸铝溶液中会含有杂质(K2SO4),请设计一个更合理的实验方案由滤液A制备纯净的硫酸铝溶液。依照上图形式画出制备流程图:(提示:在箭头上下方标出所用试剂或实验操作)

(3)已知Fe(OH)3沉淀的pH是2-3.2溶液C通过调节pH可以使Fe3+沉淀完全。下列物质中,可用作调整溶液C的pH的试剂是____(填序号)。
A.铜粉 B.氨水 C.氧化铜 D.氢氧化铜
(4)利用滤液D制取硝酸铜晶体,必须进行的实验操作步骤:加热蒸发、冷却结晶、__________(填操作名称)、自然干燥。
(5)在0.1L的混合酸溶液中c(HNO3) =2 mol/L,c(H2SO4)=3 mol/L。将0.3 mol的铜放入并充分反应后,产生的铜盐的化学式是_____________,被还原的n(HNO3)=_____________。
参考答案:(1)2Al+2OH-+2H2O==2AlO2-+3H2↑(2)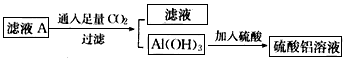 (3)CD
(3)CD
(4)过滤
(5)CuSO4;0.2 mol
本题解析:
本题难度:困难