微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某化学兴趣小组用铝土矿(主要成分为A12 O3,还含有SiO2及铁的氧化物)提取氧化铝作冶炼铝的原料,提取的操作过程如下:
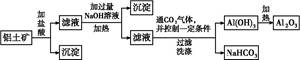
(1)在过滤操作中,除烧杯、玻璃棒外,还需用到的玻璃仪器有?;洗涤沉淀的操作是?。
(2)实验室制备氢氧化铝的方案有多种。现提供铝屑、氢氧化钠溶液、稀硫酸三种药品,若制备等量的氢氧化铝,请你从药品用量最少的角度出发,设计出最佳实验方案(方案不必给出),写出此方案中发生反应的离子方程式:?,此方案中所用药品的物质的量之比是:n(Al)∶n(H2SO4)∶n(NaOH) =?。
(3)兴趣小组欲对铝土矿中铁元素的价态进行探究:取少量固体,加入过量稀硝酸,加热溶解;取少许溶液滴加KSCN溶液后出现红色。由此得出铁元素的价态为+3的结论。请指出该结论是否合理并说明理由?。
参考答案:(1)普通漏斗?向漏斗里加入蒸馏水,使水面浸没沉淀,等水自然流完后,重复2~3次
(2)2Al+6H+=2Al3++3H2↑、2Al+2OH-+2H2O=2AlO2-+3H2↑ 、Al3++3AlO2-+6H2O=4Al(OH)3↓ ?8∶3∶6
(3)不合理,稀硝酸具有强氧化性,若铁的价态为+2价,可被氧化为+3价,同样与KSCN反应溶液显红色
本题解析:(1)过滤装置中还缺少普通漏斗。洗涤时,向过滤器中加蒸馏水浸没沉淀,等水自然流下后,重复2~3次,可洗涤其表面吸附的离子。(2)制备氢氧化铝有三种途径:铝与硫酸反应生成硫酸铝,硫酸铝与氢氧化钠反应得氢氧化铝沉淀;铝与氢氧化钠反应生成偏铝酸钠,偏铝酸钠再与硫酸反应得氢氧化铝;将铝按物质的量之比1∶3转化为Al3+、AlO2-,利用Al3+和AlO2-的相互促进水解制取氢氧化铝。写出方程式观察第三种方法最节约原料。(3)从实验现象来看,只能说明铝土矿中含有铁元素,但是铁的价态不一定是+3价,因为硝酸具有强的氧化性。
本题难度:一般
2、填空题 Ⅰ.硬铝废料(含90%铝、2.5%镁、7.5%铜)可以制取明矾KAl(SO4)2.12H2O,某探究小组设计了下列实验.
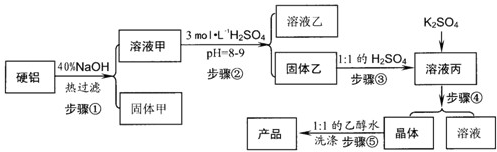
请回答以下问题:
(1)写出步骤③的离子方程式______.
(2)步骤④包括三个环节,分别是______、冷却结晶、______.
(3)步骤⑤不直接用水洗的原因是______.
Ⅱ.某课题小组同学测量液态奶含氮量的实验过程如下:
原理:液态奶
(NH4)2SO4溶液NH3(NH4)2B4O7溶液→用标准盐酸滴定
步骤:
①在烧杯中加入10.00mL液态奶和辅助试剂,加热充分反应;
②将反应液转移到大试管中;
③按如下装置用水蒸气将NH3吹出,并用H3BO3溶液吸收(加热装置未画出);
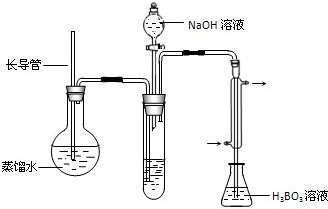
④取下锥形瓶,滴加指示剂,用0.1000mol?L-1盐酸标准液滴定;
⑤重复测定两次,再用10.00mL蒸馏水代替液态奶进行上述操作.
数据记录如下:
| 实验编号 | 样品和辅助试剂 | 消耗盐酸
体积(mL)
1
10.00mL液态奶、0.2g催化剂、20mL浓硫酸
33.45
2
10.00mL液态奶、0.2g催化剂、20mL浓硫酸
33.55
3
10.00mL液态奶、0.2g催化剂、20mL浓硫酸
33.50
4
10.00mL蒸馏水、0.2g催化剂、20mL浓硫酸
1.50
|
回答下列问题:
(1)滴定时(NH4)2B4O7重新转化为H3BO3,反应的化学方程式为______.
(2)步骤③的实验装置中需要加热的仪器是______(填仪器名称),长导管的作用是______.
(3)设计4号空白对照实验的目的是______.
(4)计算该液态奶的含氮量为______mg?mL-1.
参考答案:Ⅰ.(1)氢氧化铝与硫酸反应生成硫酸铝和水,离子方程式为Al(OH)3+3H+=Al3++3H2O,
故答案为:Al(OH)3+3H+=Al3++3H2O;?
(2)向硫酸铝溶液中加入硫酸钾,得混合溶液,通过蒸发、结晶、过滤制得明矾,故答案为:蒸发;过滤;
(3)明矾在酒精中的溶解度小,用酒精洗涤减少产品的损失,故答案为:减少产品的损失;
Ⅱ.(1)硼的化合价未变化,发生类似复分解反应,反应方程式为(NH4)2B4O7+2HCl+5H2O=4?H3BO3+2NH4Cl,
故答案为:(NH4)2B4O7+2HCl+5H2O=4?H3BO3+2NH4Cl;?
(2)加热圆底烧瓶产生水蒸气,进入试管中将生成的氨气吹出;加热产生水蒸气,装置内压强增加,长导管防止装置中压力过大而发生危险,冷却时防止发生倒吸,起安全管作用,
故答案为:圆底烧瓶;安全管;
(3)对照使用目的是消除其他试剂、实验操作等因素引起的误差,故答案为:消除其他试剂、实验操作等因素引起的误差;
(4)盐酸的体积为33.45ml+33.55ml+33.50ml3-1.5ml=32.00ml=0.03200L,
?令10ml该液态奶的含氮量的质量为mg,则?
? ?2N~(NH4)2B4O7~2HCl
? 28g? 2mol
?mg? 0.03200L×0.1000mol/L
所以m=28g×0.03200ml×0.1000mol/L2mol=0.04480g,
该液态奶的含氮量为44.8mg10ml=4.48mg/ml,
故答案为:4.48.
本题解析:
本题难度:一般
3、简答题 将0.1mol镁、铝合金溶于100mL2mol/L的H2SO4溶液中,然后滴加1mol/L的NaOH溶液,生成沉淀与所加NaOH溶液体积的关系如图所示.试回答下列问题:
(1)当溶液中Mg2+、Al3+恰好沉淀完全时,V(NaOH)=______mL;
(2)当V1=160mL时,金属粉末中镁的物质的量为多少?此时V2的值又是多少?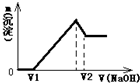
参考答案:将镁、铝合金溶于H2SO4溶液中,发生反应:Mg+H2SO4=MgSO4+H2↑;2Al+3H2SO4=Al2(SO4)3+3H2↑.0.1mol镁、铝合金,完全反应需要硫酸范围:0.1mol<n(H2SO4)<0.15mol,H2SO4有剩余(观察图象更容易得出),溶液是MgSO4、
Al2(SO4)3和H2SO4混合液.
①0--V1阶段,滴加的NaOH用于中和剩余的H2SO4,发生反应是:H2SO4+2NaOH=Na2SO4+2H2O
②V1ml时,剩余的H2SO4与滴加的NaOH恰好完全反应,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液.
③V1--沉淀量最大阶段,继续滴加的NaOH与MgSO4、Al2(SO4)3反应,产生沉淀,发生反应:
Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4;MgSO4+2NaOH=Mg(OH)2↓+Na2SO4
④沉淀量最大时时,MgSO4、Al2(SO4)3完全反应,沉淀达到最大值,此时,溶液是Na2SO4溶液.
⑤沉淀量最大--V2ml阶段,继续滴加的NaOH与Al(OH)3反应,沉淀量开始减少,发生反应:Al(OH)3+NaOH=NaAlO2+2H2O
⑥V2ml时,Al(OH)3完全反应,沉淀是Mg(OH)2,溶液是Na2SO4和NaAlO2混合液.
(1)当溶液中Mg2+、Al3+恰好沉淀完全时,即沉淀达到最大值,此时,溶液是Na2SO4溶液,根据SO42-离子和Na+离子守恒有:n(Na+)=2n(Na2SO4)=2n(H2SO4)=2×0.1L×2mol/L=0.4mol,所以,此时,V(NaOH)=0.4mol1mol/L=0.4L=400ml
故答案为:400;
(2)当V1=160mL时,此时,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,
由Na+离子守恒可知,n(Na2SO4)=12n(Na+)=12n(NaOH)=12×0.16L×1mol/L=0.08mol
令MgSO4为xmol,Al2(SO4)3为ymol,根据Mg原子、Al原子、SO42-离子守恒有:
本题解析:
本题难度:一般
4、选择题 若甲为100 mL、2 mol·L-1的AlCl3溶液,乙为100 mL、7mol·L-1的NaOH溶液,分别按以下两种步骤:将甲逐滴加入乙中;将乙逐滴加入甲中(边滴边振荡)完全混合后,对现象和结论的判断正确的是(?)
A.滴加过程中,两者的现象不同,最终产生的沉淀量相同
B.滴加过程中,两者的现象不同,最终产生的沉淀量不同
C.滴加过程中,两者的现象相同,最终产生的沉淀量相同
D.滴加过程中,两者的现象相同,最终产生的沉淀量不同
参考答案:A
本题解析:AlCl3+3NaOH====Al(OH)3↓+3NaCl
Al(OH)3+NaOH====NaAlO2+H2O
若Al3+全部转化为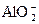 ,则n(AlCl3)∶n(NaOH)=1∶4,而实际上n(AlCl3)∶?n(NaOH)=2∶7,所以NaOH不足量,最终生成沉淀量相同;甲滴入乙时乙中NaOH大量,开始无沉淀,乙滴入甲时,AlCl3大量,一开始就有沉淀,二者现象不同。
,则n(AlCl3)∶n(NaOH)=1∶4,而实际上n(AlCl3)∶?n(NaOH)=2∶7,所以NaOH不足量,最终生成沉淀量相同;甲滴入乙时乙中NaOH大量,开始无沉淀,乙滴入甲时,AlCl3大量,一开始就有沉淀,二者现象不同。
本题难度:简单
5、选择题 下列关于铝的说法不正确的是( )
A.铝是金属元素在地壳中含量最多的元素
B.铝是比较活泼的金属,在化学反应中容易失去电子,表现还原性
C.铝箔在空气中受热可以熔化,且发生剧烈的燃烧
D.日常用的铝制品,表面总是覆盖着一层保护膜
参考答案:A.地壳含量较多的元素(前四种)按含量从高到低的排序为:氧、硅、铝、铁,其中含量最多的金属元素是铝元素,故A正确;
B.铝原子的最外层有3个电子,在化学反应中易失去3个电子而达8电子的稳定结构,失去电子表现还原性,故B正确;
C.铝和氧气反应生成了氧化铝,又因三氧化二铝的熔点高于铝的熔点,而三氧化二铝在铝的表面,所以加热铝箔的时候铝失去了光泽,铝熔化了但是不会滴落,不会出现发生剧烈的燃烧,故C错误;
D.日常用的铝制品,表面总是覆盖着一层保护膜,发生的反应为:4Al+3O2═2Al2O3,形成一层致密的Al2O3保护膜,故D正确;
故选C.
本题解析:
本题难度:一般