微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
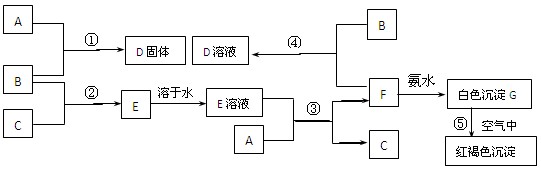
1、填空题 (8分) 在室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可以按下列框图进行反应。又知E溶液是无色溶液。请回答:
(1)? (用化学式填空)
A是______________B是________________
(2)反应①的化学方程式为___________________________________________
反应③的离子方程式为___________________________________________
反应⑤的化学方程式为___________________________________________________
参考答案:(1) A:Fe? B:Cl2? (2)?① 2Fe + 3Cl2 ="=" 2FeCl3?③ Fe +2H+ ="=" Fe2+? + H2↑
⑤ 4Fe(OH)2 + O2 + 4H2O ="=" 4Fe(OH)3
本题解析:本题是无机框图题,根据是寻找突破点。B是黄绿色气体,则B是氯气。白色沉淀G能在空气中转化为红褐色沉淀,所以G是氢氧化亚铁。因此单质A是铁,又因为C是无色气体,所以C是氢气,D是氯化亚铁,E是氯化氢,F是氯化亚铁。
本题难度:一般
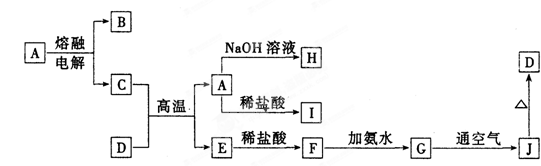
2、填空题 (12分)A—J是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已略去)。已知A是一种高熔点物质,D是一种红棕色固体。
 请回答
请回答
下列问题:
(1)A物质的名称为_________,H与I反应的化学方程式??
(2)C与D在高温下的反应在冶金工业上称为?反应,引发该反应的实验操作是?
___?
(3)写出G→J的化学方程式:___?、
(4)A→H的离子方程式为___________________________________________
(5)用离子方程式表示I物质能用于净水的原理_____________________?_
参考答案:(1)氧化铝(1分)? 3NaAlO2+AlCl3+6H2O=4Al(OH)3+3NaCl(2分)
(2)铝热(1分)?加少量KClO3,插上镁条并将其点燃(2分)
(3)4Fe(OH)2+O2+2H2O=4Al(OH)3(2分)
(4)Al2O3+2OH-+H2O=2AlO2-+H2O(2分)
(5)Al3++3H2O Al(OH)3(胶体)+3H+(2分)
Al(OH)3(胶体)+3H+(2分)
本题解析:本题是无机框图题,根据是找准突破点。D是一种红棕色固体,所以D是氧化铁,J是氢氧化铁,G是氢氧化亚铁。所以E是铁,F是氯化亚铁。A是一种高熔点物质,则A是氧化铝,所以B是氧气,C是铝,H是偏铝酸钠,I是氯化铝.
本题难度:一般
3、填空题 (15分)A、B、C、D四种均为短周期元素,原子序数依次增大
(1)A元素原子最外层电子数是核外电子层数的3倍,A与D同主族,A和D可形成两种化合物X和Y,X和水反应后生成一种具有还原性的二元酸M,M可以使溴水褪色。
(2)A元素的单质和C元素的单质化合可生成Z, Z在加热条件下跟水反应的产物1 mol需用3mol KOH才能完全中和。
(3)A元素的单质和B元素的单质一定条件下反应生成化合物N,D元素的单质和B元素的单质反应生成化合物G,化合物N和化合物G的相对分子质量相等,且焰色反应均呈黄色。
回答下列问题:
(1)画出元素D的离子结构示意图:?;
(2)A、B、C、D四种元素的原子半径按由小到大排列的顺序为(用相应的元素符号表示):?
(3)M可以使溴水褪色,写出该反应的离子方程式?;
(4)Z与热水反应的化学方程式?。
(5)化合物N与化合物G的水溶液反应,若氧化剂与还原剂物质的量之比为1:1,该反应的离子方程式为??
(6)常温下,D的氢化物呈气态,有毒,水溶液呈酸性。脱除天然气中D的氢化物既能减少环境污染,又可回收D的单质。用过量NaOH溶液吸收D的氢化物后,以石墨作电极电解该溶液可回收D的单质,其电解总反应的化学方程式(忽略溶解氧的氧化还原反应)为?;
该方法的优点是?。
参考答案:(1)?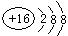 ?(1分);?(2)O<S <P< Na?(2分)
?(1分);?(2)O<S <P< Na?(2分)
(3)H2SO3 + Br2 + H2O = 4H+ + SO42- + 2Br- (2分)?
(4)P2O5+3H2O(热)=2H3PO4?(2分)
(5)Na2O2 + S2- + 2H2O = 2Na+ + S + 4OH- (3分)
(6)Na2S + 2H2O S↓+ H2↑+ 2NaOH(3分)
S↓+ H2↑+ 2NaOH(3分)
本题解析:生成的NaOH可循环利用,副产氢气可以作为化工原料或燃料 (2分)
由(1)知A、D分别为O、S,形成的化合物X和Y分别为SO2与SO3、M为H2SO3;由(2)知C元素为P、Z是P2O5;由(3)知B为Na,化合物N、G分别是Na2O2、Na2S。然后利用元素周期律和有关物质的性质可顺利的解答有关问题。
本题难度:一般
4、简答题 甲、乙、丙为短周期元素形成的常见单质,A、B、C、D、E、F、G、X均为常见的化合物.B、X的式量(分子量)相同,E的式量比D大16,在一定条件下各物质之间相互转化如下图所示:
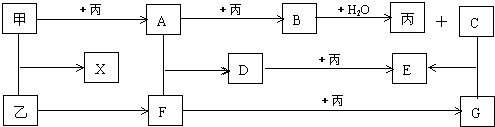
(1)X的电子式是______,G的化学式是______.
(2)上述物质中能与水发生反应(不考虑单纯的盐的水解)且反应中水既不是氧化剂也不是还原剂的物质的代号______.
(3)反应“D+丙”的化学方程式是______.
(4)写出X与D在稀硫酸中反应的离子方程式______.
参考答案:甲、乙、丙为短周期元素形成的常见单质,A、B、C、D、E、F、G、X均为常见的化合物,B和水反应生成单质丙和C,能和水反应生成单质的短周期元素化合物只有过氧化钠,所以丙是氧气,C是氢氧化钠,B是过氧化钠,化合物A和氧气反应生成过氧化钠,则A是氧化钠,钠和氧气反应生成氧化钠,则甲是钠;
B、X的式量(分子量)相同,且X中含有钠元素,硫化钠和过氧化钠的式量相同,所以X是硫化钠,则乙是硫单质,硫反应生成F,则F中含有硫元素,F能和氧气反应生成G,氢氧化钠和G能反应生成E,G是三氧化硫或硫酸,则F是亚硫酸或二氧化硫,硫不能一步反应生成亚硫酸,所以F是二氧化硫,则G是三氧化硫,氧化钠和二氧化硫反应生成D,D是亚硫酸钠,亚硫酸钠和氧气反应生成硫酸钠,则硫酸钠比亚硫酸钠的式量大16,与已知条件符合,故推断正确.
(1)硫和钠反应生成硫化钠,硫化钠是离子化合物,其电子式为:

,G是三氧化硫,其化学式为:SO3,故答案为:

;SO3;
(2)能与水发生反应(不考虑单纯的盐的水解)且反应中水既不是氧化剂也不是还原剂,说明反应过程中水中各元素的化合价都不发生变化,能和水反应的物质有钠、氧化钠、过氧化钠、三氧化硫和二氧化硫,在和水反应中水既不是氧化剂也不是还原剂的是氧化钠、过氧化钠、二氧化硫和三氧化硫,故选A、B、F、G;?
(3)亚硫酸钠不稳定,易被氧气氧化生成硫酸钠,反应方程式为:2Na2SO3+O2═2Na2SO4,
故答案为:2Na2SO3+O2═2Na2SO4;
(4)硫离子和亚硫酸根离子反应生成硫单质和水,离子反应方程式为:2S2-+SO32-+6H+═3S↓+3H2O,
故答案为:2S2-+SO32-+6H+═3S↓+3H2O.
本题解析:
本题难度:一般
5、简答题 如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;

请完成下列填空:
(1)H的化学式______;其晶体中所含化学键类型为______;检验H中阳离子的方法是______.
(2)A与B在加热条件下反应的主要现象是______;F和H2O反应的化学方程式为______;写出G溶液中加入过量的I溶液反应的离子方程式______.
(3)某温度时,在2L容器中,D、E、J三种物质的物质的量随时间变化的曲线如图所示.由图中数据分析:该反应的化学方程式为______.反应开始至2min,用J表示的平均反应速率为______.
参考答案:已知B、C、D、E是非金属单质,且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态,依据转化关系中的反应特征和条件C+D=I的反应条件是光照,推断为氢气和氯气的反应,I+J=铵盐H,说明I是HCl,J是NH3,D为H2,C、Cl2,E为N2,化合物G的焰色反应为黄色说明含钠元素,G+I=CO2,证明G为碳酸盐;B是非金属单质是F和二氧化碳反应生成的,推断F为Na2O2,B为O2,A为Na;
(1)H的化学式为NH4Cl;晶体中所含化学键类型为离子键、共价键;检验H(NH4Cl)中阳离子(NH4+)的方法为:取少量H样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子,
故答案为:NH4Cl;离子键、共价键;取少量H样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子;
(2)A(Na)与B(O2)在加热条件下反应的主要现象是:剧烈反应,火焰为黄色,生成淡黄色的固体;F(Na2O2)和H2O反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑;G(NH4Cl)溶液中加入过量的I(HCl)溶液反应的离子方程式:CO32-+2H+=CO2↑+H2O,
故答案为:剧烈反应,火焰为黄色,生成淡黄色的固体;2Na2O2+2H2O=4NaOH+O2↑;CO32-+2H+=CO2↑+H2O;
(3)由图中数据分析发生的反应为D+E=J,D、E消耗物质的量为n(H2)=1.0mol-0.7mol=0.3mol;n(N2)=1.0mol-0.9mol=0.1mol,生成J的物质的量为:n(NH3)=0.2mol,反应物质的量之比为n(H2):n(N2):n(NH3)=0.3mol:0.1mol:0.2mol=3:1:2,该反应的化学方程式为N2+3H2 2NH3;用J(NH3)表示的反应速率=0.2mol2L2min=0.05mol/L?min,
2NH3;用J(NH3)表示的反应速率=0.2mol2L2min=0.05mol/L?min,
故答案为:N2+3H2 2NH3;0.05mol/L?min.
2NH3;0.05mol/L?min.
本题解析:
本题难度:简单