微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (16分)A、D、E、X、Y是原子序数依次增大的短周期主族元素。其中X原子最外层电子数是内层电子总数的3倍;X、Y同族;A与X、Y既不同族也不同周期;D元素的某种同位素原子在考古方面有重要应用。
(1)Y的离子结构示意图为?。
(2)钠、A和X三种元素组成的化合物,其所含的化学键类型有??。
(3)甲由A、E两种元素组成,分子中含有18个电子,只存在共价单键。常温下甲是一种无色液体。
①甲是一种二元弱碱, 写出其一级电离方程式:?。
写出其一级电离方程式:?。
②甲在碱性溶液中能够将CuO还原为Cu2O, 已知每1mol甲参加反应有 4 mol电子转移,该反应的化学方程式为:?。
已知每1mol甲参加反应有 4 mol电子转移,该反应的化学方程式为:?。
(4)处理含DX、YX2烟道气污染的一种方法,是在催化剂作用下使两者反应,产物之一为单质Y。已知反应生成1 g Y固体单质时放出8.4 kJ热量,此反应的热化学方程式为?。
(5)将0.050 mol YX2(g)和0.030 mol X2(g)放入容积为1 L的密闭容器中,反应: X2(g) +2YX 2(g) 2YX3(g)在一定条件下达到平衡。
2YX3(g)在一定条件下达到平衡。
①若其他条件不变,增大体系的压强,平衡常数K?(填“增大”、“减小”或“不变”)。
②平衡时测得c(X2)=0.010 mol·Lˉ1。该条件下反应的平衡常数K=?,YX2的平衡转化率为?。
参考答案:(16分)
(1)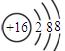 (1分)
(1分)
(2)离子键、共价键(2分)
(3)①N2H4 +H2O N2H5++ OHˉ (2分)
N2H5++ OHˉ (2分)
②N2H4 +4CuO=N2↑+2Cu2O+2H2O?(3分)
(4)2CO(g)+SO2(g)=2CO2(g)+S(s)?ΔH="–268.8" kJ·molˉ1 (3分)
(5)①不变(1分)
②1.6×103 ?80%或0.8(各2分,共4分)
本题解析:略
本题难度:简单
2、推断题 下列转化关系图中,A、B、C、D、E常温下为气体,B、E、 F、K为单质,其中F为黑色固体;C、D均能使澄清的石灰水变混浊,D、E均能使品红溶液褪色;I是一种红棕色固体氧化物。?
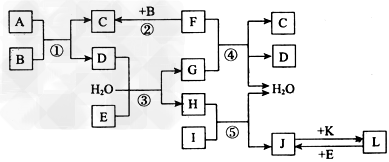
请回答下列问题: ?
(1)E的电子式为_________。 ?
(2)反应③的离子方程式为________。 ?
(3)F与G的浓溶液反应的化学方程式为_________。 ?
(4)检验溶液L中金属阳离子的方法是___________ ?
(5)气体A的密度为相同状况下氢气密度的30倍,且A中含3种组成元素,通过计算、推理,可确定A的分子式为_____________(此分子式中元素符号书写次序按从左往右元素原子序数“大 ?小中”顺序排列);A分子中各原子均达8电子稳定结构,则其结构式为____________。
参考答案:(1)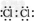
(2)?Cl2+2H2O+SO2=4H++2Cl-+SO42-
(3)C+2H2SO4(浓) ?CO2↑+2SO2↑+2H2O
?CO2↑+2SO2↑+2H2O
(4)向溶液中滴加KSCN溶液,无明显现象,滴加氯水之后,溶液变为红色
(5)SCO? ;S=C=O(或O=C=S)
本题解析:
本题难度:一般
3、推断题 下图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去。 常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为金属单质。反应①②均为工业上 的重要反应。
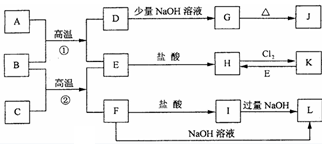
请回答下列问题:
(1)D的电子式为____。
(2)K的化学式为____。
(3)写出B与C高温反应生成E和F的化学方程式:___。
(4)写出D与J的稀溶液反应生成G的离子方程式___。
参考答案:(1) 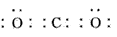
(2)FeCl3
(3)Fe2O3+2Al Al2O3+2Fe
Al2O3+2Fe
(4)CO2+CO32-+H2O==2HCO3-
本题解析:
本题难度:一般
4、简答题 X、Y是中学化学里常用的物质,其中Y是单质,X是化合物;它们之间相互反应以及生成物之间的关系如图所示:
已知E溶液跟NH4SCN的稀溶液混合时,溶液呈血红色.请回答:
(1)Y和X浓溶液反应的条件是______,而常温下难反应的原因是______.
(2)写出F和G相互转化的化学方程式:F→G+X______G→F______
(3)L转化成I的现象是______,有关的化学方程式是______.
参考答案:X、Y是中学化学里常用的物质,其中Y是单质,X是化合物;它们之间相互反应以及生成物之间的关系如图所示:已知E溶液跟NH4SCN的稀溶液混合时,溶液呈血红色,说明E含有Fe3+离子,加入氢氧化钠溶液生成氢氧化铁沉淀I为Fe(OH)3,L为Fe(OH)2,H为含Fe2+离子的溶液;K为推断Y为Fe,D为H2O,J为O2,依据Y和X的浓溶液反应生成的F和D反应生成G和X,判断F为NO2,X为HNO3,G为NO,所以推断出E为Fe(NO3)3,H为Fe(NO3)2,依据推断得到的物质分别为:X为HNO3,Y为Fe;D为H2O,Fe(NO3)3,H为Fe(NO3)2,F为NO2,G为NO,J为O2,K为NaNO3,L为
Fe(OH)2,I为Fe(OH)3;
(1)Y和X浓溶液反应的条件是加热,常温下铁在浓硝酸中 发生钝化现象;
故答案为:加热,Fe表面被浓硝酸钝化;
(2)依据分析推断得到F→G+X反应的化学方程式为:3NO2+H2O=2HNO3+NO,G→F反应的化学方程式为:2NO+O2=2NO2
故答案为:3NO2+H2O=2HNO3+NO,2NO+O2=2NO2
(3)L转化成I是氢氧化亚铁被一氧化为氢氧化铁,反应的现象是:白色固体迅速变为灰绿色,最后变为红褐色,有关的化学方程式是?4Fe(OH)2+2H2O+O2=4Fe(OH)3;
故答案为:白色固体迅速变为灰绿色,最后变为红褐色; 4Fe(OH)2+2H2O+O2=4Fe(OH)3;
本题解析:
本题难度:一般
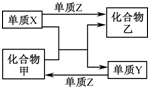
5、选择题 X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物.下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是( )?
| 选项 | X | Y | Z | 甲 | 乙
A
H2
Si
Cl2
SiCl4
HCl
B
Mg
C
O2
CO2
MgO
C
Zn
Fe
Cl2
FeCl2
ZnCl2
D
O2
N2
H2
NH3
H2O
|
A.A
B.B
C.C
D.D