| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《水的电离平衡》考点预测(2017年强化版)(十)
参考答案:D 本题解析:酸碱抑制水的电离,能水解的盐促进水的电离,强酸强碱盐对水的电离无影响,所以水在硫酸铵中的电离程度最大,酸碱的浓度越大,对水的电离抑制程度越大,所以同浓度的NaOH、H2SO4溶液中,水在硫酸中的电离程度最小,因此水的电离程度按由大到小顺序排列的是④>①>②>③,选D。 本题难度:一般 2、选择题 常温下用pH试纸测定某溶液的pH,如果将pH试纸用蒸馏水润湿后,再把待测液滴到pH试纸上,跟比色卡对照,测得pH=6。则此溶液的实际pH |
参考答案:B
本题解析:pH试纸使用时不能用蒸馏水润湿,若润湿,会导致溶液浓度降低,对酸性溶液来说,润湿后PH=6,说明原溶液的氢离子浓度大,则PH<6,选B。
考点:考查PH试纸的使用。
本题难度:一般
3、选择题 已知某温度下,0.l mol·L-1NaHB溶液中,C(H+)>c(OH-),则下列各关系式一定正确的是
A.c(Na+)=c(HB-)+2c(B2-)+c(OH-)
B.溶液的pH="1"
C.c(Na+)="0.l" mol·L-1≥c(B2-)
D.C(H+).c(OH-)=10-14
参考答案:C
本题解析:
A.根据题意,NaHB是强电解质,溶液呈酸性,如果存在HB-,则 HB-的电离程度大于水解程度,即 NaHB溶液中含有的离子是(Na+)、(H+)、c(HB-)、c(B2-)、c(OH-),根据电荷守恒得:c(Na+)+c(H+)=c(HB-)+2c(B2-)+c(OH-),故A错误;
B.NaHB是强电解质,溶液呈酸性,可能有两种情况,即HB-能够完全电离,也可能部分电离.当HB-完全电离时,0.1mol/L的NaHB的pH=1,当HB-部分电离时,0.1mol/L的NaHB的pH>1.故B错误;
C.NaHB是强电解质,说明0.1mol/L的NaHB的溶液中c(Na+)=0.1mol/L.根据B项的分析,当HB-完全电离时,0.1mol/L的NaHB的c(B2-)=0.1mol/L,当HB-部分电离时,c(B2-)<0.1mol/L.因此,c(Na+)=0.1mol/L≥c(B2-),故C正确;
D.在0.1mol/L的NaHB溶液中,无法求解氢离子的浓度,因而无法确定c(H+)-c(OH-)=10-14,但是可以知道c(H+)×c(OH-)=10-14,故D错误;
故选C.
本题难度:简单
4、选择题 下列说法正确的是
[? ]
A.25℃水的电离常数是1.0×10-14
B.中性溶液的c(H+)=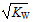
C.纯水在100℃时,c(H+)>10-7mol·L-1,所以此时纯水中c(H+)>c(OH-)
D.pH<7的溶液一定是酸溶液
参考答案:AB
本题解析:
本题难度:一般
5、选择题 加入水能抑制水的电离的物质是( )
A.碘化钾
B.氯化钠
C.硝酸钠
D.硫酸
参考答案:D
本题解析:酸、碱抑制水的电离,能水解的盐促进水的电离,A、B、C对水的电离平衡没有影响。
考点:影响水电离平衡的因素
点评:酸、碱抑制水的电离,能水解的盐促进水的电离。
本题难度:一般
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高考化学知识点总结《有机化合物.. | ||