微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列热化学方程式书写正确的是(△H的绝对值均正确)( )
A.C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g);△H=-1367.0kJ/mol(燃烧热)
B.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热)
C.S(s)+O2(g)═2SO2(g);△H=-269kJ/mol(反应热)
D.2NO2═O2+NO;△H=+116.2kJ/mol(反应热)
参考答案:C
本题解析:
本题难度:一般
2、填空题 (Ⅰ)甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源。
(1)25℃、101 kPa时,1 mol CH3OH完全燃烧生成稳定的氧化物放出热量726.51 kJ/mol,则甲醇燃烧的热化学方程式为: 。
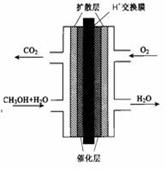
(2)甲醇燃料电池的结构示意图如下。甲醇进入 极(填“正”或“负”),写出该极的电极反应式 。
(Ⅱ)铅蓄电池是典型的可充型电池,它的正负极隔板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42- 2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原):
2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原):
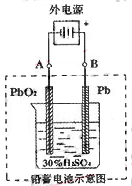
(1)放电时:正极的电极反应式是 电解液中H2SO4的浓度将变 ;
(2)在完全放电耗尽PbO2和Pb时,若按右图连接,电解一段时间后,则在A电极上生成 B电极上生成 。
参考答案:(Ⅰ)(1)CH3OH(l) + 3/2 O2(g)= CO2(g) + 2H2O(l) △H ="-726.51" kJ/mol
(2)负 CH3OH + H2O -6 e-= CO2+ 6 H+
(Ⅱ)(1)PbO2+2e-+4H++SO42-=PbSO4+2H2O 小 (2)Pb PbO2
本题解析:(Ⅰ)(1)1molCH3OH完全燃烧生成稳定的氧化物为气态二氧化碳和液态水,放出热量726.51kJ/mol,以此书写热化学方程式;(2)甲醇燃料电池中,甲醇为负极,电解质为酸,甲醇失去电子生成二氧化碳;(Ⅱ)(1)电池总反应式为:Pb+PbO2+4H++2SO2-4 2PbSO4+2H2O,写出电极反应为:负极电解反应:Pb-2e-+SO42-=PbSO4 ,正极电极反应:PbO2+2e-+4H++SO42-=PbSO4+2H2O,放电时:正极的电极反应式是PbO2+2e-+4H++2SO42-=PbSO4+2H2O;电解液中H2SO4的浓度将减少;当外电路通过1mol电子时,依据电子守恒计算理论上负极板的质量增加;(2)在完全放电耗尽PbO2和Pb时,电极上是析出的PbSO4,若按题右图连接B为阳极应是失去电子发生氧化反应,A为阴极是得到电子发生还原反应,实质是电解反应,B电极上发生反应为:PbSO4+2H2O-2e-=PbO2+4H++2SO42-,A电极发生反应为:PbSO4=Pb-2e-+SO42-,所以A电极上生成Pb;B极生成PbO2,此时铅蓄电池的正负极的极性将对换。
2PbSO4+2H2O,写出电极反应为:负极电解反应:Pb-2e-+SO42-=PbSO4 ,正极电极反应:PbO2+2e-+4H++SO42-=PbSO4+2H2O,放电时:正极的电极反应式是PbO2+2e-+4H++2SO42-=PbSO4+2H2O;电解液中H2SO4的浓度将减少;当外电路通过1mol电子时,依据电子守恒计算理论上负极板的质量增加;(2)在完全放电耗尽PbO2和Pb时,电极上是析出的PbSO4,若按题右图连接B为阳极应是失去电子发生氧化反应,A为阴极是得到电子发生还原反应,实质是电解反应,B电极上发生反应为:PbSO4+2H2O-2e-=PbO2+4H++2SO42-,A电极发生反应为:PbSO4=Pb-2e-+SO42-,所以A电极上生成Pb;B极生成PbO2,此时铅蓄电池的正负极的极性将对换。
考点:热化学方程式;化学电源新型电池;用盖斯定律进行有关反应热的计算
本题难度:困难
3、选择题 在101 kPa和25 ℃时,有关反应的热化学方程式如下:
C(s)+1/2O2(g) =CO(g) ΔH1=-110.5 kJ·mol-1
H2(g)+ 1/2O2(g)=H2O(g) ΔH2=-241.7 kJ·mol-1
H2(g)+ 1/2O2(g)=H2O(l) ΔH3=-285.8 kJ·mol-1
下列说法正确的是( )
A.C(s)+H2O(g)=CO(g)+H2(g) ΔH=-131.2 kJ·mol-1
B.H2燃烧热的热化学方程式为:2H2(g)+O2(g)=2H2O (l)ΔH=-571.6 kJ·mol-1
C.2H2O(g)=2H2(g)+O2 (g)ΔH=-483.4 kJ·mol-1
D.H2O(g)=H2O(l)ΔH=-44.1 kJ·mol-1