微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)? ΔH=?867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130℃和180℃时,分别将0.50 molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:
N2(g)+CO2(g)+2H2O(g)? ΔH=?867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130℃和180℃时,分别将0.50 molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:
实验编号
| 温度
| ?
时间
| 0
| 10
| 20
| 40
| 50
|
1
| 130℃
| n(CH4)/mol
| 0.50
| 0.35
| 0.25
| 0.10
| 0.10
|
2
| 180℃
| n(CH4)/mol
| 0.50
| 0.30
| 0.18
| ?
| 0.15
|
?
(1)开展实验1和实验2的目的是?。
(2)180℃时,反应到40min,体系?(填“是”或“否”)达到平衡状态,理由是?;CH4的平衡转化率为?。
(3)已知130℃时该反应的化学平衡常数为6.4,试计算a的值。(写出计算过程)
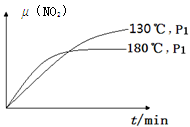
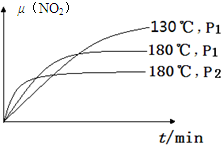
(4)一定条件下,反应时间t与转化率μ(NO2)的关系如图所示,请在图像中画出180℃时,压强为P2(设压强P2>P1)的变化曲线,并做必要的标注。
(5)根据已知求算:ΔH2=?。
CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g)? ΔH1=?574 kJ·mol-1
4NO(g)+CO2(g)+2H2O(g)? ΔH1=?574 kJ·mol-1
CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g)? ΔH2
2N2(g)+CO2(g)+2H2O(g)? ΔH2
参考答案:(16分)有效数字错误或无单位运算或无作答,总扣1分
(1)研究温度对该化学平衡的影响(2分)
(2)是(1分)?温度升高,反应加快,对比实验1,高温下比低温下更快达到平衡状态。可确定40min时反应已经达平衡状态(2分)? 70%(2分)
(3)? CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)
N2(g)+CO2(g)+2H2O(g)
起始浓度(mol/L):? 0.5? n? 0? 0? 0
变化浓度(mol/L):? 0.40? 0.80? 0.40? 0.40? 0.80
平衡浓度(mol/L):? 0.10? n-0.80? 0.40? 0.40? 0.80?(2分)
则: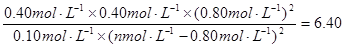 ,解得a=1.2?
,解得a=1.2?
答:a的值为1.2?(2分)
(4)
(2分,无标注扣1分)?
(5)?1160kJ/mol(3分)
本题解析:(1)控制变量进行探究才能尽快得出合理结论,依题意可知,实验1和2的研究目的是温度对化学平衡的影响,其他条件保持不变,仅仅反应温度分别为130℃、180℃;(2)130℃时,反应到40min时甲烷的物质的量保持不变,说明已达平衡,升高温度,反应速率增大,达到平衡的时间缩短,则180℃时,反应到40min,体系一定达到平衡状态;由于平衡时甲烷的物的量保持不变,读表可知平衡时甲烷为0.15mol,由于起始时甲烷为0.50mol,则甲烷的平衡转化率=(0.50—0.15)mol/0.50mol×100%=70%;(3)根据表中数据,130℃时:
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)
N2(g)+CO2(g)+2H2O(g)
起始浓度(mol/L)? 0.5? n? 0? 0? 0
变化浓度(mol/L)? 0.4? 0.8? 0.4? 0.4? 0.8
平衡浓度(mol/L)? 0.1? n—0.8? 0.4? 0.4? 0.8
则130℃时该反应的K=[c(N2)×c(CO2)×c2(H2O)]/[c(CH4)×c2(NO2)]=(0.4×0.4×0.82)/[0.1×(n—0.8)2]=6.4, 解得:n=1.2;
(4)180℃、P1变为180℃、P2,就是增大压强,则反应速率增大,平衡左移,二氧化氮的平衡转化率减小,因为正反应是气体体积增大的反应;画图要点为:①起点与180℃、P1时相同;②未达平衡前,180℃、P2时曲线位于180℃、P1时曲线的左边;③180℃、P2时达到平衡的时间小于180℃、P1时;④平衡时,180℃、P2时曲线位于180℃、P1时曲线的下边;
(5)CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)? ΔH=?867 kJ·mol-1,由于系数加倍焓变也加倍,则2CH4(g)+4NO2(g)
N2(g)+CO2(g)+2H2O(g)? ΔH=?867 kJ·mol-1,由于系数加倍焓变也加倍,则2CH4(g)+4NO2(g) 2N2(g)+2CO2(g)+4H2O(g)? ΔH=?2×867 kJ·mol-1,由于CH4(g)+4NO2(g)
2N2(g)+2CO2(g)+4H2O(g)? ΔH=?2×867 kJ·mol-1,由于CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g)? ΔH1=?574 kJ·mol-1,根据盖斯定律,前者减去后者可得CH4(g)+4NO(g)
4NO(g)+CO2(g)+2H2O(g)? ΔH1=?574 kJ·mol-1,根据盖斯定律,前者减去后者可得CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g),且焓变等于?1160kJ/mol,故ΔH2=?1160kJ/mol。
2N2(g)+CO2(g)+2H2O(g),且焓变等于?1160kJ/mol,故ΔH2=?1160kJ/mol。
本题难度:一般
2、选择题 合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:
CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0
CO2(g)+H2(g) ΔH<0
反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
A.增加压强
B.降低温度
C.增大CO的浓度
D.更换催化剂
参考答案:B
本题解析:该反应为气体物质的量不变的反应,压强改变对平衡无影响,A错误;反应ΔH<0,降低温度,平衡正向移动,CO转化率增大,B正确;增大CO浓度,CO转化率减小,C错误;催化剂的使用对平衡无影响,D错误。
本题难度:一般
3、填空题 硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下:
(1)以N2和H2为原料合成氨气。一定温度下,在密闭容器中充入1 mol N2和3 mol H2发生反应。若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的 ,则N2的转化率а1=_________;若容器压强恒定,达到平衡状态时,N2的转化率为а2,则а2____(填“>”“<”或 “=”)а1。
,则N2的转化率а1=_________;若容器压强恒定,达到平衡状态时,N2的转化率为а2,则а2____(填“>”“<”或 “=”)а1。
(2)用氨催化氧化法可生产硝酸,其生产过程可表示为:4NH3+5O2 4NO+ 6H2O;
4NO+ 6H2O;
4NO + 3O2 + 2H2O = 4HNO3。现以3.4吨液氨为原料来生产质量分数为50%的硝酸,理论上需要加水的质量为_______吨。(假设生产过程中反应物和生成物均无损耗)
(3)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:2NO2+ Na2CO3 = NaNO2 + NaNO3+
CO2,NO+ NO2+Na2CO3=2NaNO2+ CO2。若在标准状况下有NO、NO2的混合气体(不考虑N2O4)恰好与50 mL 1.0mol/L的Na2CO3溶液反应完全,且生成NaNO2和NaNO3的物质的量之比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程)
参考答案:(1)12.5% 或1/8;>
(2)9
(3)设NaNO2和NaNO3的物质的量分别为4a和a,由Na元素守恒可得4a+a=50×10-3L×1.0 mol/L,解得a=0.02 mol。由2NO2~NaNO2~NaNO3,NO~NO2~NaNO2可求得NO的物质的量为0.03 mol,NO2的物质的量为0.07 mol,则混合气体中NO气体的体积分数为30%。
本题解析:
本题难度:一般
4、选择题 已知反应:2SO2(g)+O2(g)  ?2
?2 SO3(g);ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
SO3(g);ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
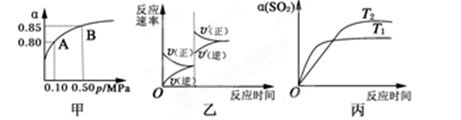
A.由图甲知,A点SO2的平衡浓度为0.4 mol·L-1
B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2:1:2
C.达平衡后,缩小容器容积,则反应速率变化图像可以用图乙表示
D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1
参考答案:C
本题解析:略
本题难度:一般
5、计算题 在标准状况下,1 mol A气体发生如下反应:
2A(g) B(g)+xC(g)
B(g)+xC(g)
达到平衡时,在混合气中A的体积分数为58.6%,混合气的总质量为46 g,密度为1.772 g·L-1。试计算:
(1)达平衡后,混合气的平均相对分子质量__________。
(2)达平衡后,A的转化率_________________。
(3)C气体的化学计量数x的数值__________________。
参考答案:(1)39.7 g·mol
(2)67.9%
(3)x=2
本题解析:(1)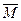 ="22.4" L·mol×1.772 g·L="39.7" g·mol
="22.4" L·mol×1.772 g·L="39.7" g·mol
(2)设A的转化量为2a。
2A B+xC
B+xC
起? 1? 0? 0
转? 2a? a? ax
平? 1-2a? a? ax
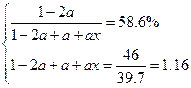 ?解之
?解之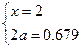
A的转化率=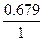 ×100%="67.9%?" x=2
×100%="67.9%?" x=2
本题难度:简单