微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是( )
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率
2、选择题 100mL 6mol·L-1 H2SO4跟足量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的
[? ]
A.碳酸钠固体
B.水
C.硫酸钾固体
D.醋酸钠固体
3、选择题 升高温度反应速度加快的主要原因是
A.分子运动速度加快
B.活化能增加
C.体系能量增加
D.活化分子的百分数增加
4、简答题 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
| 实验编号 | 反应物 | 催化剂
①
10mL2%?H2O2溶液
无
②
10mL5%?H2O2溶液
无
③
10mL5%?H2O2溶液
1mL0.1mol?L-1FeCl3溶液
④
10mL5%?H2O2溶液+少量HCl溶液
1mL0.1mol?L-1FeCl3溶液
⑤
10mL5%?H2O2溶液+少量NaOH溶液
1mL0.1mol?L-1FeCl3溶液
|
(1)催化剂能加快化学反应速率的原因是______.
(2)实验①和②的目的是______.实验时由于较长时间没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是______.
(3)写出实验③的化学反应方程式______.
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图.分析上图能够得出的实验结论是______.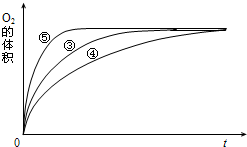
5、选择题 下列描述违背化学原理的是( )
A.“冰,水为之,而寒于水”,说明相同质量的水和冰,水的能量高
B.可逆反应A(g)+3B(g)?2C(g)达平衡后,增大压强,正速率增大,逆速率减小
C.SO2的催化氧化生成SO3,是一个放热的反应,升高温度,反应速率加快
D.电解熔融NaCl时,阴极的电极反应式为:Na++e-=Na