微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 我国化学家侯德榜改革国外的Na2CO3生产工艺,创造了侯氏制碱法,又叫联邦制碱法,该法是将合成氨工厂生产的NH3及副产品
CO2,通入到饱和食盐水中得到NaHCO3,分离出的NaHCO3加热制得Na2CO3.某研究性学习小组设计如图所示的模拟装置,该装置可实现部分原料的循环使用.
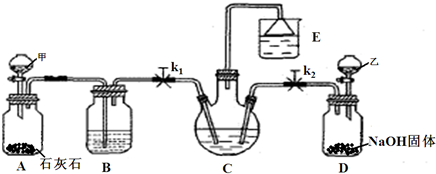
(1)分液漏斗甲中为盐酸,装置B中试剂为______,分液漏斗乙中是易挥发的某试剂,该试剂为______.
(2)实验操作过程中,应先打开______(填“k1”或“k2”),当观察到______现象时,再打开另一个弹簧夹.
(3)装置E中试剂为饱和NaCl溶液,该装置能体现绿色化学思想的两个作用是______、______.
(4)老师认为在C、D之间还应增加一个装置,该装置作用为______.
(5)写出C中生成NaHCO3的化学方程式______.
参考答案:(1)分液漏斗甲中为盐酸,滴入A中和石灰石反应生成二氧化碳气体,气体中含有氯化氢气体,装置B中试剂为饱和NaHCO3溶液,依据候氏制碱原理可知D装置是制备氨气的装置,结合液体滴入固体氢氧化钠产生氨气实验判断,乙分液漏斗中为浓氨水滴入后会生成氨气通入C装置反应;分液漏斗乙中是易挥发的某试剂,该试剂为浓氨水;
故答案为:饱和NaHCO3溶液;浓氨水
(2)候氏制碱方法是利用氨气溶解性大极易溶解于水,二氧化碳气体水中溶解性较小,实验饱和食盐水中先通入氨气,再通入二氧化碳气体;实验操作过程中,应先打开k2,观察到E中漏斗有液面上升时,再打开另一个弹簧夹K1.故答案为:k2,观察到E中漏斗有液面上升时;
(3)装置E中试剂为饱和NaCl溶液,该装置能体现绿色化学思想的两个作用是:吸收氨气防止污染;获得NaCl和氨水的饱和液循环使用;
故答案为:吸收氨气防止污染;获得NaCl和氨水的饱和液循环使用;
(4)氨气极易溶于水直接通入食盐水会发生倒吸,实验CD间应加一个放倒吸的装置,故答案为:防止倒吸;
(5)C中生成NaHCO3的化学方程式:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl;故答案为:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl;
本题解析:
本题难度:一般
2、选择题 与索尔维制碱法相比,侯德榜制碱法最突出的优点是( )
A.原料利用率高
B.设备少
C.循环利用的物质多
D.原料易得
参考答案:A
本题解析:
本题难度:简单
3、填空题 工业生产纯碱的工艺流程示意图如下
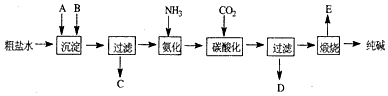
完成下列填空
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。
A_____________B____________
(2)实验室提纯粗盐的实验操作依次为:取样、________、沉淀、_________、__________、冷却结晶、_________、烘干。
(3)工业生产纯碱工艺流程中,碳酸化时产生的现象是____________。碳酸化时没有析出碳酸钠晶体,其原因是____________。
(4)碳酸化后过滤,滤液D最主要的成分是____________(填写化学式),检验这一成分的阴离子的具体方法是:______________________________。
(5)氨碱法流程中氨是循环使用的,为此,滤液D加入石灰水产生氨。加石灰水后所发生的反应的离子方程式为:_____________________滤液D加石灰水前先要加热,原因是________________________。
(6)产品纯碱中含有碳酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为:__________________(注明你的表达式中所用的有关符号的含义)
参考答案:(1)Ca(OH)2或CaO;Na2CO3
(2)溶解;过滤;蒸发;过滤
(3)有晶体析出(或出现浑浊);碳酸钠溶解度比碳酸氢钠大
(4)NH4Cl;取样,加硝酸酸化,加硝酸银,有白色沉淀,该阴离子是氯离子
(5)NH4++OH-==NH3↑+H2O;防止加石灰水时产生碳酸钙沉淀
(6) (m1:加热前纯碱的质量、m2:加热后纯碱的质量)
(m1:加热前纯碱的质量、m2:加热后纯碱的质量)
本题解析:
本题难度:一般
4、简答题 纯碱(Na2CO3)在生产生活中具有广泛的用途.图1是实验室模拟制碱原理制取Na2CO3的流程图.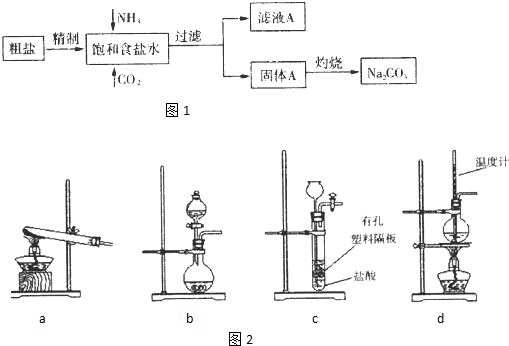
已知:向饱和食盐水中通入NH3、CO2后发生和反应为NaCl+NH3+CO2+H2O→NaHCO3↓+NH4Cl,请回答以下问题:
(1)粗盐中含有的杂质离子有Ca2+,Mg2+,SO42-等.
精制除杂的步骤顺序a→______→______→______→b(填字母编号).
a.粗盐溶解,滤去沉渣.b.加入盐酸调pH;c.加入Ba(OH)2溶液;d.加入Na2CO3溶液;e.过滤
向饱和食盐水中先通入NH3,后通入CO2,理由是______.
(2)灼烧固体A制Na2CO3在______(填字母序号)中进行.
a.坩埚b.蒸发皿c.烧杯d.锥形瓶
证明滤液A中含有NH4+的 方法是______.
对滤液A进行重结晶能够获得NH4HCO3,向pH=13含Na+、K+的溶液中加入少量NH4HCO3.使pH降低,反应的离子方程式______.
(3)图2装置中常用于实验室制备CO2的是______(填字母编号);用b示意的装置制备NH3,分液漏斗中盛放的试剂______(填试剂名称),烧瓶内可加入的固体试剂______(填试剂名称).
(4)一种天然碱晶体成分是aNa2CO3?bNa2CO3?cH2O,某同学利用下列提供的试剂,设计了如下简单合理测定Na2CO3的质量分数的实骏方案.(仪器自选)请把实验方案填全:供选择的试剂:1mol?L-1H2SO4溶液、1.0mol?L-1BaCl2溶液、稀氨水、碱石灰、Ca(OH)2溶液、蒸馏水.
①称取m1g一定量天然碱晶体样品,溶于适量蒸馏水中.
②______.
③______.
④计算天然碱晶体中含Na2CO3的质量分数.
参考答案:(1)SO42-、Ca2+、Mg2+等分别与Ba(OH)2溶液、Na2CO3溶液、Ba(OH)2溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液能除去过量的Ba(OH)2溶液,盐酸能除去过量的Na2CO3溶液和NaOH溶液,所以应先加Ba(OH)2溶液再加Na2CO3溶液,过滤,最后加入盐酸,NH3易溶于水,有利于吸收溶解度不大的CO2,所以向饱和食盐水中先通入NH3,后通人CO2,
故答案为:c;d;e;NH3易溶于水,有利于吸收溶解度不大的CO2;
(2)灼烧固体碳酸氢钠制Na2CO3,在坩埚加热分解,
取少量滤液A于试管中,加入足量NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝色的气体,证明A中含有
NH4+,NH4+和HCO3-都能与氢氧化钠反应:NH4++HCO3-+2OH-=NH3?H2O+CO32-+H2O,
故答案为:a;取少量滤液A于试管中,加入足量NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝色的气体,证明A中含有NH4+;NH4++HCO3-+2OH-=NH3?H2O+CO32-+H2O;
(3)实验室制取二氧化碳常选用石灰石和稀盐酸或大理石和稀盐酸反应制取,采用固体+液体不加热
本题解析:
本题难度:一般
5、填空题 (三选一)【化学与技术】
纯碱一直以来都是工业生产的重要原料,很长一段时间纯碱的制法都被欧美国家所垄断。上个世纪初,我国著名的工业化学家侯德榜先生经过数年的反复研究终于发明了优于欧美制碱技术的联合制碱法(又称侯氏制碱法)。并在天津建造了我国独立研发的第一家制碱厂。其制碱原理的流程如图
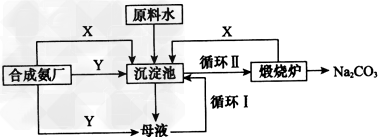
(1)侯德榜选择天津作为制碱厂的厂址有何便利条件(举二例说明):______、_____。
(2)合成氨工厂需要向制碱厂提供两种原料气体,它们分别是 ____、____(填化学式);这两种气体在使用过程中是否需要考虑添加的顺序:____(填“是”或“否”),原因是____________________。
(3)在沉淀池中发生的反应的化学方程式:________________。
(4)使原料水中溶质的利用率从70%提高到90%以上,主要是设计了__________(填上述流程中的编号)。从母液中可以提取的副产品的应用是____________(举一例)。
参考答案:(1)原料丰富;运输便利
(2)CO2;NH3;是;氨气在水中溶解度大,先通氨气后通CO2产生碳酸氢铵多,有利于碳酸氢钠析出
(3)NaCl(饱和)+CO2+NH3+H2O=NaHCO3↓+NH4Cl
(4)循环I;作化肥
本题解析:
本题难度:一般